Die molekulare Basis des Lernens
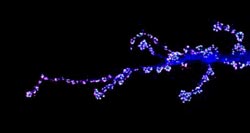
Motoneuron einer Fliegenlarve. Blau kennzeichnet das Motorneuron, grün das präsynaptische Schlüsselmolekül Bruchpilot und magentafarben die Glutamatrezeptorfelder.<br>Foto: AG Robert Kittel<br>
Irgendetwas zwischen 100 und 1000 Milliarden Nervenzellen besitzt das menschliche Gehirn. Jede einzelne von ihnen steht mit durchschnittlich 1000 anderen Zellen in Kontakt. Über synaptische Verbindungen hinweg tauschen sich die Zellen untereinander aus und steuern so unser Denken, Handeln und Empfinden.
Gleichzeitig schafft es dieses hoch komplexe Netzwerk, sich in einem ständigen Prozess der Selbstorganisation an veränderte Bedingungen anzupassen. Es versetzt seinen Träger so in die Lage, mit völlig neuen und unerwarteten Situationen fertig zu werden und kann selbst dann noch leistungsfähig arbeiten, wenn es Schaden genommen hat.
Synaptische Plastizität
Plastizität lautet der Fachausdruck für diese Wandlungsfähigkeit; synaptische Plastizität ist eine ihrer Unterformen. Lernen basiert auf dieser Fähigkeit des Gehirns, neue Verknüpfungen zu bilden, bestehende zu verstärken und ungenutzte wieder abzubauen. Wissenschaftler vom Physiologischen Institut der Universität Würzburg haben untersucht, welche molekularen Veränderungen dabei an den Synapsen ablaufen. Die Fachzeitschrift Cell Reports berichtet darüber in ihrer neuesten Ausgabe.
„Die synaptische Plastizität ist schon lange bekannt. Eine besonders einflussreiche Hypothese hat der kanadische Psychologe Donald O. Hebb bereits 1949 in seiner berühmten Lernregel formuliert“, sagt Dr. Robert Kittel. Kittel ist Leiter einer Emmy-Noether-Gruppe am Physiologischen Institut; gemeinsam mit seinen Mitarbeitern Dmitrij Ljaschenko und Nadine Ehmann hat er den Cell Press-Artikel verfasst.
Verkürzt formuliert, sagt Hebb: Je häufiger ein bestimmtes Neuron gleichzeitig mit einem anderen Neuron aktiv ist, umso bevorzugter werden die beiden Neuronen aufeinander reagieren – ganz nach dem Motto: what fires together, wires together – was zusammen feuert, verbindet sich.
Motoneurone im Visier
„Obwohl man heute weiß, dass synaptische Aktivität und die Entwicklung der Synapsen aufs Engste miteinander verbunden sind, ist unser Wissen über den molekularen Mechanismus dieses Zusammenhangs längst nicht vollständig“, sagt Robert Kittel. Allerdings ist es ihm und seinem Team jetzt gelungen, neue Details aufzuklären – mit Fliegenlarven, blauem Licht und einem genauen Blick auf die molekularen Details.
In ihren Experimenten haben sich die Wissenschaftler auf die sogenannten „Motoneurone“ der Fliegenlarven konzentriert. Dabei handelt es sich um Nervenzellen, die Muskeln kontaktieren und ihnen über ihre Synapsen beispielsweise den Befehl erteilen, sich zu verkürzen. Die Dynamik an diesen Stellen ist groß: „Der Muskel der Fliegenlarve wächst binnen weniger Tage um das Hundertfache. Dementsprechend müssen auch die Synapsen nachwachsen“, sagt Kittel.
Noch aus einem anderen Grund sind Fliegen-Motoneurone für die Forschung interessant: Als Botenstoff überträgt bei ihnen Glutamat die Information von der Prä- zur Postsynapse – sprich: von der Nervenzelle auf den Muskel. Beim Menschen ist Glutamat der Hauptbotenstoff im Gehirn. Dementsprechend hat sich bewährt, dass Erkenntnisse über die Vorgänge am Larven-Motoneuron auf den Menschen – und andere Säugetiere – gut übertragbar sind.
Lichtblitze an Fliegenlarven
Mit einer trickreichen Technik, die unter dem Stichwort „Optogenetik“ bekannt wurde, konnten die Wissenschaftler die Aktivität der Motoneurone steuern. Dazu haben sie sogenannte Kanalrhodopsine in die Zellwände eingebaut. Kanalrhodopsine sind Ionenkänale, die durch Licht gesteuert werden. Durch Ionenkanäle leiten Zellen elektrische geladene Teilchen durch ihre Zellmembran ins Zellinnere hinein oder in den extrazellulären Raum hinaus. Nervenzellen nutzen diesen Mechanismus beispielsweise für die Signalweiterleitung von Sinnesempfindungen ans Gehirn und zur Steuerung der Muskeln. Einer der Entdecker dieser Technik, Professor Georg Nagel, ist Professor am Lehrstuhl für Molekulare Pflanzenphysiologie und Biophysik der Universität Würzburg. Mit Kittels Gruppe arbeitet er in einigen Projekten zusammen.
„Da Fliegenlarven praktischerweise durchsichtig sind, mussten wir sie nur noch blauen Lichtpulsen aussetzen, um so eine Aktivität in den Neuronen zu erzeugen“, erklärt Kittel. Über 100 Minuten hinweg brachten die Wissenschaftler die Nervenzellen auf diese Weise dazu, Signale an die Muskeln zu senden. Im Anschluss daran untersuchten sie, welche funktionellen und molekularen Veränderungen in den Synapsen stattgefunden hatten.
Die wichtigsten Ergebnisse
Nach der intensiven Aktivität der Motoneurone war die postsynaptische Empfindlichkeit – also die Empfindlichkeit auf Seiten der Muskeln deutlich erhöht. Dort hatte die Zelle vermehrt Glutamat-Rezeptoren einer speziellen Untereinheit – sogenannte Typ-2A-Rezeptoren – eingebaut. „Allerdings trat dieser Effekt nur dann auf, wenn Nerv und Muskel gleichzeitig stimuliert worden waren“, sagt Kittel. Ein Befund, der das Team hellhörig machte – entspricht er doch genau der Hebb’schen Regel, nach der Verbindungen dann gestärkt werden, wenn die Beteiligten gleichzeitig aktiv sind.
Umgekehrt wurden diese 2A-Untereinheiten wieder sehr schnell von solchen Synapsen entfernt, deren Aktivität nicht dazu in der Lage war, auf Seiten des Muskels eine substanzielle Aktivität zu erzeugen. Auch das ist ein sinnvoller Prozess: „Wenn die Menge der Rezeptoren immer nur zunehmen könnte, würde das System bald kollabieren“, sagt Kittel. Deshalb müsse es zwingend auch eine Möglichkeit geben, „das System zu bremsen“. Schickt also eine Synapse als einzige dem Muskel den Befehl zum Kontrahieren, reicht das in der Regel nicht dafür aus, eine Reaktion hervorzurufen. In der Folge wird sie für ihren Alleingang durch den Entzug von Rezeptoren „bestraft“.
Ein „vielversprechendes physiologisches Konzept“ seien diese Erkenntnisse, sagt Kittel. Sie lieferten ein Bild von den molekularen Vorgängen der synaptischen Plastizität und zeigen, wie beim Hebb’schen Lernen Synapsen reifen und eine spärliche Transmitterfreigabe die Stabilisierung der molekularen Zusammensetzung individueller Synapsen kontrolliert. Mit diesem Wissen über die grundlegenden Mechanismen sei es nun möglich, auch an anderen Stellen zu überprüfen, ob sie dort gleichermaßen gelten.
Hebbian Plasticity Guides Maturation of Glutamate Receptor Fields In Vivo. Dmitrij Ljaschenko, Nadine Ehmann and Robert J. Kittel. Cell Reports, online published May 2. http://dx.doi.org/10.1016/j.celrep.2013.04.003
Kontakt
Dr. Robert Kittel, T: (0931) 31-86046, robert.kittel@uni-wuerzburg.de
Media Contact
Weitere Informationen:
http://www.uni-wuerzburg.deAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Wolken bedecken die Nachtseite des heißen Exoplaneten WASP-43b
Ein Forschungsteam, darunter Forschende des MPIA, hat mit Hilfe des Weltraumteleskops James Webb eine Temperaturkarte des heißen Gasriesen-Exoplaneten WASP-43b erstellt. Der nahe gelegene Mutterstern beleuchtet ständig eine Hälfte des Planeten…
Neuer Regulator des Essverhaltens identifiziert
Möglicher Ansatz zur Behandlung von Übergewicht… Die rapide ansteigende Zahl von Personen mit Übergewicht oder Adipositas stellt weltweit ein gravierendes medizinisches Problem dar. Neben dem sich verändernden Lebensstil der Menschen…

Maschinelles Lernen optimiert Experimente mit dem Hochleistungslaser
Ein Team von internationalen Wissenschaftlerinnen und Wissenschaftlern des Lawrence Livermore National Laboratory (LLNL), des Fraunhofer-Instituts für Lasertechnik ILT und der Extreme Light Infrastructure (ELI) hat gemeinsam ein Experiment zur Optimierung…