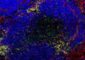
Der Ryanodin-Rezeptor: Schleuse für Kalzium in Muskelzellen

Wenn Muskeln sich zusammen ziehen, sind die sogenannten Ryanodin-Rezeptoren gefordert. Durch diese Ionenkanäle werden die Kalzium-Ionen aus Speicherorganen freigesetzt, die letztlich die Kontraktion der Muskelzellen auslösen.
Defekte Ryanodin-Rezeptoren können beispielsweise zu Herzrhythmusstörungen oder plötzlichem Herzstillstand führen. Forscher vom Max-Planck-Institut für molekulare Physiologie in Dortmund haben nun den dreidimensionalen Aufbau des Rezeptors analysiert.
Die Forscher haben die Rezeptoren in winzige Nano-Membranen eingefügt, damit sie die Proteine in einem Milieu untersuchen können, die ihrer natürlichen Umgebung in der Zelle ähnelt.
Mithilfe der Kryo-Elektronenmikroskopie und einer neuen Detektionstechnik für Elektronen haben die Forscher den Aufbau des Rezeptors mit einer bisher unerreichten Genauigkeit sichtbar gemacht. Mit diesem Wissen könnten Wissenschaftler in Zukunft neue Wirkstoffe entwickeln, mit denen sich Schädigungen des Ryanodin-Rezeptors behandeln lassen.
Der Ryanodin-Rezeptor bildet einen Kanal, durch den Kalzium-Ionen in die Zelle fließen können. Die Animation zeigt, wie das Protein seine Struktur verändert, wenn Kalzium-Ionen an ihn binden: Durch eine komplexe Bewegung öffnet sich der Kanal.
Vier im Zentrum liegende Proteinabschnitte bilden eine Art Türsteher-Region („ion gate“), die nur Kalzium-Ionen passieren lässt und andere zurückhält.
Die sogenannte „EF-Hand“ ist der Sensor, mit dem das Protein Kalzium-Ionen erkennt. Dieser in verschiedenen Proteinen vorkommende Abschnitt aus elektrisch geladenen Aminosäuren ändert seine räumliche Struktur, wenn Kalzium an ihn bindet, und öffnet dadurch die Türsteher-Region.
Originalpublikation:
Julian von der Ecken, Mirco Müller, William Lehman, Dietmar J. Manstein, Pawel A. Penczek & Stefan Raunser
Structure of the F-actin-tropomyosin complex
Nature, 1. December 2014, published online
Ansprechpartner:
Dr. Stefan Raunser
Max-Planck-Institut für molekulare Physiologie, Dortmund
Telefon:+49 231 133-2356Fax:+49 231 133-2399
E-Mail:stefan.raunser@mpi-dortmund.mpg.de
Dr. Peter Herter
Max-Planck-Institut für molekulare Physiologie, Dortmund
Telefon:+49 231 133-2500Fax:+49 231 133-2599
E-Mail:peter.herter@mpi-dortmund.mpg
Weitere Informationen:
http://www.mpg.de/8784106/ryanodin_rezeptor_struktur Der Ryanodin-Rezeptor in Bewegung
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

FDmiX: Schnelle und robuste Serienproduktion von Nanopartikeln
Verkapselungstechnologie der nächsten Generation… Nukleinsäure-basierte Medikamente wie mRNA-Impfstoffe bieten ein enormes Potenzial für die Medizin und eröffnen neue Therapieansätze. Damit diese Wirkstoffe gezielt in die Körperzellen transportiert werden können, müssen…

Sensor misst Sauerstoffgehalt in der Atemluft
Eine zu geringe oder zu hohe Sauerstoffsättigung im Blut kann bleibende körperliche Schäden bewirken und sogar zum Tod führen. In der Intensiv- und Unfallmedizin wird die Sauerstoffkonzentration der Patientinnen und…
Neue MRT-Technik erkennt Schlaganfälle in kürzester Zeit
Tag gegen den Schlaganfall: Forschende der Universitätsmedizin Mainz haben im Rahmen einer Studie erstmals eine KI-gestützte Magnetresonanz-Tomographie (MRT)-Methode untersucht, um akute ischämische Schlaganfälle effizienter detektieren zu können. Dabei setzten sie…