Schlüsselmolekül für Zellwanderung identifiziert
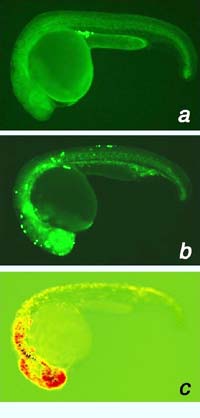
Abbildung 1: Die Wanderung (Migration) von Keimzellen beim Zebrafisch wird durch die Verteilung von SDF-1 gesteuert. (reproduced from Cell 111(5): 647-659 (2002)
Wie bilden sich Organe, woher wissen die Zellen eines Embryos, wohin sie im Laufe der Entwicklung wandern müssen? Göttinger Wissenschaftler haben jetzt ein Molekül identifiziert, das bei der Migration von Keimzellen in Zebrafischen eine entscheidende Rolle spielt.
Das Wissen könnte langfristig auch helfen, schädigende Zellwanderungen beim Menschen zu kontrollieren.
Im Laufe der Entwicklung von Lebewesen entstehen Zellen oft an anderer Stelle als den Orten, an denen sie später gebraucht werden. Sie müssen erst dorthin gelangen. Die Untersuchung solcher Zellwanderungen (Migration) und die Identifizierung der zugrunde liegenden molekularen Zusammenhänge hilft Biologen, die grundlegenden Prozesse bei der Entwicklung von Gewebe und Organen zu verstehen. Mit diesem Wissen kann man dann Therapien zur Behandlung von Krankheiten entwickeln, die auf eine abnormale Zellmigration zurückzuführen sind. Ein wichtiges Modell bei der Untersuchung solcher Prozesse ist die Zellmigration von Keimzellen. Während der embryonalen Entwicklung wandern diese Zellen weite Distanzen vom Ort der Entstehung bis zu ihrem Zielorgan, den Genitalien, wo sie sich zu Spermien oder Eiern weiterentwickeln. Welche Moleküle die Keimzellen zum Ziel führen, wusste man bisher jedoch noch nicht.
Eine Arbeitsgruppe am Max-Planck-Institut für biophysikalische Chemie in Göttingen, unter der Leitung von Dr. Erez Raz, hat jetzt Licht ins Dunkel gebracht und – an Zebrafischen – einen molekularen Signalweg identifiziert, der diese Wanderung steuert. Zebrafische sind ein ideales Studienobjekt für Zellwanderungen: Die Embryos entwickeln sich rasch und außerhalb des Mutterleibes – und sie sind durchsichtig, was für mikroskopische Betrachtungen geradezu ideal ist. Mit gentechnischen Methoden kann man zudem die spezifischen Eigenschaften von verschiedenen Zebrafisch-Mutanten untersuchen und so auf molekulare Zusammenhänge schließen. In einer jetzt in Cell veröffentlichten Arbeit hat die Arbeitsgruppe gezeigt, dass während der frühen Entwicklung des Zebrafisches die Keimzellen von „SDF-1“ („stromal-cell derived factor-1“) geleitet werden, einem Faktor, der auch für die Mobilisierung von Blutstammzellen, Leukozyten und Neuronen wichtig ist. Auch bei der Entstehung von Krebsmetastasen, bei HIV-Infektionen und Arthritis spielt SDF-1 eine entscheidende Rolle.
Um die Verteilung von SDF-1 im Embryo überhaupt wahrnehmen zu können, bedienen sich die Keimzellen eines Rezeptors (mit dem Namen CXCR4), an den SDF-1 bindet. Die Arbeitsgruppe um Erez Raz konnte zeigen, dass dieser Rezeptor während der Migration in den Keimzellen produziert wird und es ihnen dadurch ermöglicht, in diejenige Richtung zu wandern, wo die Konzentration von SDF-1 am höchsten ist. Das dynamische Expressionsmuster von SDF-1 während der normalen Embryonalentwicklung führt die Keimzellen präzise zum Zielorgan, der Region der zukünftigen Genitalien (Abb. 1a). Störungen des Signalweges führen zu schweren Migrationsdefekten. Wird zum Beispiel die Aktivität von SDF-1 oder des entsprechenden Rezeptors reduziert, können die Keimzellen sich nicht mehr orientieren und verteilen sich ungeordnet im gesamten Embryo (Abb. 1b). Umgekehrt kann man mit erhöhten SDF-1-Konzentrationen Keimzellen in Regionen locken, wo sie normalerweise nicht gefunden werden. In Fischembryos, in denen die Aktivität des eigenen SDF-1 unterdrückt und SDF-1 von außen an zufälligen Positionen injiziert wurde, konnten die Keimzellen zu abnormalen Regionen gelenkt werden (Abb. 1c).
Damit sind ein wichtiger Teil des Signalweges, durch den Keimzellen wandern, und der zugrunde liegende molekulare Mechanismus identifiziert; die Arbeitsgruppe untersucht diese Mechanismen gegenwärtig in anderen Modellorganismen. Der beobachteten „Anziehung“ der Keimzellen durch SDF-1 in Zebrafischen liegt ein ähnlicher Mechanimus zugrunde wie der Zellbewegung bei bestimmten Krankheiten des Menschen, zum Beispiel wenn sich bei rheumatischer Arthritis T-Zellen in den Gelenken anlagern oder wenn Brustkrebszellen Metastasen in Gewebe bilden, das SDF-1 exprimiert, wie z.B. Knochenmark, Leber oder Lunge. Die Keimzellmigration bei Zebrafischen könnte daher als Modell zur Untersuchung dieser Krankheiten dienen. Man könnte nach Molekülen suchen, die mit dem SDF-1-Signalweg interferieren, und dies an den Fischen überprüfen.
Dr. Erez Raz
MPI biophysikalische Chemie
AG Keimzellentwicklung
37070 Göttingen
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Wolken bedecken die Nachtseite des heißen Exoplaneten WASP-43b
Ein Forschungsteam, darunter Forschende des MPIA, hat mit Hilfe des Weltraumteleskops James Webb eine Temperaturkarte des heißen Gasriesen-Exoplaneten WASP-43b erstellt. Der nahe gelegene Mutterstern beleuchtet ständig eine Hälfte des Planeten…
Neuer Regulator des Essverhaltens identifiziert
Möglicher Ansatz zur Behandlung von Übergewicht… Die rapide ansteigende Zahl von Personen mit Übergewicht oder Adipositas stellt weltweit ein gravierendes medizinisches Problem dar. Neben dem sich verändernden Lebensstil der Menschen…

Maschinelles Lernen optimiert Experimente mit dem Hochleistungslaser
Ein Team von internationalen Wissenschaftlerinnen und Wissenschaftlern des Lawrence Livermore National Laboratory (LLNL), des Fraunhofer-Instituts für Lasertechnik ILT und der Extreme Light Infrastructure (ELI) hat gemeinsam ein Experiment zur Optimierung…