Rabiate Zellen auf Wanderschaft
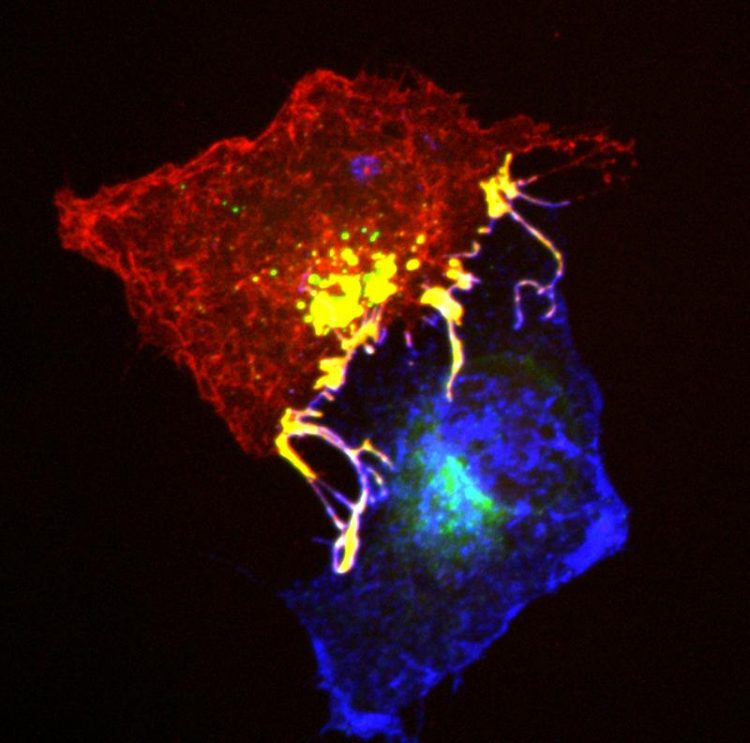
Die stabilen Proteinkomplexe (gelb) zwischen zwei Zellen werden zum Trennen der Zellen mit Hilfe des Signalproteins Tiam in eine der Zellen hineingezogen (gelbe Punkte in der roten Zelle). MPI für Neurobiologie / Gaitanos
Entwicklung ist ein rasanter Prozess. Immer mehr Zellen entstehen und müssen ihre Position im Körper finden, sich gegeneinander abgrenzen, um Gewebe zu bilden, oder, wie im Fall des Nervensystems, weit entfernte Partnerzellen kontaktieren. „Zu dem Gedränge kommt ein ordentliches Geschubse“, sagt Rüdiger Klein, der mit seiner Abteilung am Max-Planck-Institut für Neurobiologie untersucht, wie Zellen sich zurechtfinden.
„Eine beliebte Methode, einer anderen Zelle die Richtung zu weisen, ist das Wegstoßen nach kurzem Kontakt.“ Nach Beobachtung der Wissenschaftler gehen die Zellen dabei nicht gerade zimperlich miteinander um und verschlucken sogar ganze Stücke aus der Membran der jeweils anderen Zelle.
Wenn Zellen miteinander in Kontakt treten, geschieht dies oft über Ephrine und Eph-Rezeptoren. Diese Proteine befinden sich auf der Oberfläche fast aller Zellen. Treffen zwei Zellen aufeinander, verbinden sich ihre Ephrine und Eph-Rezeptoren zu festen Ephrin/Eph-Komplexen. Diese Komplexe setzen daraufhin über Signalketten den Abstoßungsprozess in Gang.
„Nun kommt das Problem, denn anscheinend wollen sich die Zellen dann so schnell wie möglich trennen – doch durch die stabilen Ephrin/Eph-Komplexe hängen die beiden Zellen aneinander“, erklärt Rüdiger Klein. Also machen die Zellen etwas anderes: Sie stülpen die eigene Zellmembran so weit über die einzelnen Komplexe, bis sich der Komplex samt angrenzender Membran aus der Nachbarzelle herauslöst und ganz in die Zelle aufgenommen wird.
Dass Zellen diesen als Endozytose bekannten Vorgang nutzen können, um sich voneinander zu trennen, fanden die Max-Planck-Forscher bereits 2003 heraus. Fortschritte in der Molekularbiologie haben es ihnen nun ermöglicht zu zeigen, wie der Vorgang im Detail gesteuert wird.
Mit einer Reihe genetischer Modifikationen und dem gezielten Ausschalten einzelner Zellkomponenten konnten die Wissenschaftler zeigen, dass durch die Bildung des Ephrin/Eph-Komplexes Tiam-Signalproteine aktiviert werden. Als Folge werden Rac-Enzyme aktiv, die wiederum durch eine lokale Umstrukturierung des Aktin-Zellskeletts zum Ausstülpen der Zellmembran über den Ephrin/Eph-Komplexe führen. Fehlt eine dieser Komponenten, ist die Aufnahme des Komplexes durch Endozytose blockiert, und somit können die Zellen sich nicht abstoßen und hängen aneinander fest.
Die Aufklärung dieses Signalwegs ist wichtig, um die Entwicklung von neuronalen Netzwerken und anderen Organsystemen besser zu verstehen. Das Ergebnis ist jedoch auch für die Krebsforschung sehr interessant: Ephrine und Eph-Rezeptoren spielen durch ihre Fähigkeit, die Zellabstoßung zu steuern, eine große Rolle beim Eindringen von Krebszellen in Gewebe und der Metastasenbildung.
Daher stehen die Rezeptoren und ihre Bindungspartner im Fokus aktueller medizinischer Forschung. Sind die Komponenten des Signalweges bekannt, über den die Zellabstoßung gelenkt wird, könnten sich daraus neue Ansatzpunkte für Therapeutika entwickeln.
ORIGINALVERÖFFENTLICHUNG
Thomas N. Gaitanos, Jorg Koerner, Rüdiger Klein
Tiam/Rac signaling mediates trans-endocytosis of ephrin receptor EphB2 and is important for cell repulsion
Journal of Cell Biology, 5. September 2016
KONTAKT
Dr. Stefanie Merker
Presse- und Öffentlichkeitsarbeit
Max-Planck-Institut für Neurobiologie, Martinsried
Tel.: 089 – 8578 3514
E-Mail: merker@neuro.mpg.de
Prof. Dr. Rüdiger Klein
Abteilung „Moleküle – Signale – Entwicklung“
Max-Planck-Institut für Neurobiologie, Martinsried
Tel.: 089 – 8578 3150
Email: rklein@neuro.mpg.de
http://www.neuro.mpg.de/klein/de – Webseite der Abteilung von Prof. Rüdiger Klein
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Diamantstaub leuchtet hell in Magnetresonanztomographie
Mögliche Alternative zum weit verbreiteten Kontrastmittel Gadolinium. Eine unerwartete Entdeckung machte eine Wissenschaftlerin des Max-Planck-Instituts für Intelligente Systeme in Stuttgart: Nanometerkleine Diamantpartikel, die eigentlich für einen ganz anderen Zweck bestimmt…

Neue Spule für 7-Tesla MRT | Kopf und Hals gleichzeitig darstellen
Die Magnetresonanztomographie (MRT) ermöglicht detaillierte Einblicke in den Körper. Vor allem die Ultrahochfeld-Bildgebung mit Magnetfeldstärken von 7 Tesla und höher macht feinste anatomische Strukturen und funktionelle Prozesse sichtbar. Doch alleine…

Hybrid-Energiespeichersystem für moderne Energienetze
Projekt HyFlow: Leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem für moderne Energienetze. In drei Jahren Forschungsarbeit hat das Konsortium des EU-Projekts HyFlow ein extrem leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem entwickelt, das einen…





















