Einblick in die Struktur eines Proteintransporthelfers
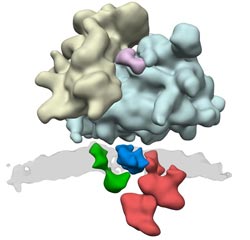
Viele Proteinkomplexe sind an der Synthese von Eiweißen beteiligt. Durch das ER-Translokon (grün, blau und rot) wird das neu synthetisierte Protein über die Membran (grau) in das ER geschleust.<br><br>Grafik: Friedrich Förster / Copyright: MPI für Biochemie<br>
Um ihre Aufgaben korrekt ausführen zu können, werden viele Proteine nach ihrer Herstellung mit Anhängen wie Zuckerresten versehen. Dieser Prozess ist direkt an den Transport durch eine Membran gekoppelt.
Wissenschaftlern am Max-Planck-Institut (MPI) für Biochemie ist es jetzt mit Hilfe verschiedener strukturbiologischer Methoden gelungen, einen Einblick in die Architektur des verantwortlichen Proteinkomplexes (ER-Translokon) zu gewinnen. Die Ergebnisse des Gemeinschaftsprojekts wurden jetzt in Nature Communications veröffentlicht.
Ein Protein herzustellen, ist für die Zelle ein hoch komplexer Prozess und beinhaltet viele einzelne Schritte. Je nachdem für welchen Zweck ein Protein gebraucht wird, gibt es verschiedene Orte der Proteinproduktion: das Zellinnere, auch Zellplasma genannt, oder das Endoplasmatische Retikulum (ER).
Das ER ist durch eine Membran von seiner Umgebung, dem Zellplasma, getrennt. Proteine, die am ER hergestellt werden, gelangen noch während der Synthese über diese Membran in das Innere des ERs und werden dabei durch das Anhängen von Zuckerresten verändert. Ohne diese Anhänge können sich Proteine nicht korrekt falten und so auch ihre Aufgaben in der Zelle nicht erfüllen.
Wissenschaftler der Forschungsgruppe „Modellierung von Proteinkomplexen“ konnten jetzt die Architektur des Proteinkomplexes beschreiben, der für den Transport und die Veränderung des neu produzierten Proteins verantwortlich ist: das ER-Translokon. „Es befindet sich in der Membran des ERs, was neben seiner Größe und komplexen Zusammensetzung bisherige strukturelle Untersuchungen erheblich erschwert hat“, beschreibt Friedrich Förster, Gruppenleiter am MPI für Biochemie, die Ausgangssituation. Die Strukturen vieler Untereinheiten sowie ihre Anordnung im Gesamtkomplex des ER-Translokons waren daher bisher unbekannt.
Erst durch die Verwendung der Kryo-Elektronentomographie konnten die Forscher einen ersten Einblick in die Architektur des ER-Translokons erhalten. Die Probe wird „schockgefroren“, sodass ihre natürliche Struktur erhalten bleibt. Dann nehmen die Wissenschaftler aus verschiedenen Blickwinkeln zweidimensionale Bilder des Objekts im Elektronenmikroskop auf, aus denen sie schließlich ein dreidimensionales Bild rekonstruieren. Weitere Untersuchungen machten es möglich, einzelne Untereinheiten in der Struktur zu identifizieren. Darunter ist auch die Untereinheit, die Zuckerreste an das neu produzierte Protein knüpft.
„Basierend auf dieser Methodik wollen wir jetzt versuchen, die Struktur und Lage weiterer Komponenten des ER-Translokons zu bestimmen“, so Förster. Kennen die Forscher die einzelnen Strukturen des ER-Translokons, können sie indirekt auf die genaue Funktionsweise und das Zusammenwirken aller Bestandteile rückschließen.
Originalveröffentlichung
Pfeffer, S., Dudek, J., Gogala, M., Schorr, S., Linxweiler, J., Lang, S., Becker, T., Beckmann, R., Zimmermann, R., Förster, F.: Structure of the mammalian oligosaccharyl-transferase complex in the native ER protein translocon. Nature Commun, January 10, 2014
Doi: 10.1038/ncomms4072 (2013).
Kontakt
Dr. Friedrich Förster
Modellierung von Proteinkomplexen
Max-Planck-Institut für Biochemie
Am Klopferspitz 18
82152 Martinsried
Email: foerster@biochem.mpg.de
http://www.biochem.mpg.de/foerster
Anja Konschak
Öffentlichkeitsarbeit
Max-Planck-Institut für Biochemie
Am Klopferspitz 18
82152 Martinsried
Tel. +49 89 8578-2824
E-Mail: konschak@biochem.mpg.de
Weitere Informationen:
http://www.biochem.mpg.de/foerster
– Webseite der Forschungsgruppe „Modellierung von Proteinkomplexen“ (Friedrich Förster)
http://www.biochem.mpg.de/3678792/072_foerster_er-translokon
– vollständige Pressemitteilung
Media Contact
Weitere Informationen:
http://www.biochem.mpg.deAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge
Experiment öffnet Tür für Millionen von Qubits auf einem Chip
Forschenden der Universität Basel und des NCCR SPIN ist es erstmals gelungen, eine kontrollierbare Wechselwirkung zwischen zwei Lochspin-Qubits in einem herkömmlichen Silizium-Transistor zu realisieren. Diese Entwicklung eröffnet die Möglichkeit, Millionen…

Stofftrennung trifft auf Energiewende
Trennkolonnen dienen der Separation von unterschiedlichsten Stoffgemischen in der chemischen Industrie. Die steigende Nutzung erneuerbarer Energiequellen bringt nun jedoch neue Anforderungen für einen flexibleren Betrieb mit sich. Im Projekt ColTray…

Kreuzfahrtschiff als Datensammler
Helmholtz-Innovationsplattform und HX Hurtigruten Expeditions erproben neue Wege in der Ozeanbeobachtung. Wissenschaftliche Forschung nicht nur von speziellen Forschungsschiffen aus zu betreiben, sondern auch von nicht-wissenschaftlichen Schiffen und marinen Infrastrukturen –…