Neuer Signalweg bei Bakterien entdeckt
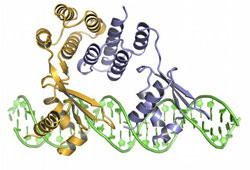
Dreidimensionale Darstellung des Regulatorproteins CtsR, an DNA gebunden (CtsR bestehend aus 2 Untereinheiten in violett und ocker) IMP
Proteine sind Ketten aus Aminosäuren, die sich im Raum zu dreidimensionalen Strukturen falten. Sie werden von einer zelleigenen Maschinerie produziert, die die Anweisungen der Gene in die Reihenfolge der Kettenglieder übersetzt. Ein Gen – ein Protein, das war lange Zeit ein Dogma der Molekularbiologie.
Mittlerweile kennt die Wissenschaft zahlreiche Modifikationen, mit denen Proteine nach ihrer Synthese aufgepeppt werden: durch Anhängen von kleinen Molekülen, Bildung von chemischen Brücken, Abspalten von Aminosäuren oder Anfügen und Durchtrennen von Eiweißketten wird das Funktionsspektrum der Proteine dramatisch erweitert. Die Vielfalt an Regulationsmöglichkeiten erklärt auch das Paradox der relativ geringen Anzahl von Genen beim Menschen.
Eine der häufigsten und wichtigsten Modifikationen ist die Phosphorylierung. Durch Hinzufügen und Abspalten von Phosphatresten kann die Funktion eines Proteins sehr präzise kontrolliert werden. Wie mit einem molekularen Schalter werden auf diese Weise etwa Enzyme ein- und ausgeknipst. Die Zelle nutzt das reversible System unter anderem, um Signale aufzunehmen und weiterzuleiten. Der Mechanismus ist bewährt, er wurde von den einzelligen Bakterien bis zum Menschen beibehalten. Die Überträger der Phosphatreste, die Kinasen, spielen daher in allen Organismen eine zentrale Rolle im Stoffwechsel. Sie sind auch an der Entstehung von Krankheiten und am Wachstum von Tumoren beteiligt und daher ein wichtiger Angriffspunkt bei der Entwicklung von neuen, selektiv wirkenden Medikamenten.
Wissenschaftler am Forschungsinstitut für Molekulare Pathologie haben nun eine neue Klasse von Kinasen aufgespürt. Mit biochemischen und strukturbiologischen Methoden gelang es der Gruppe um Tim Clausen, eine sogenannte Protein Arginin-Kinase zu identifizieren. Die Forscher isolierten das Enzym aus Bacillus stearothermophilus, einem wärmeliebenden Bodenbakterium. In der kommenden Ausgabe der Zeitschrift SCIENCE (5.6.2009) beschreiben sie ihre Erkenntnisse und Methoden.
Die neu beschriebene Kinase trägt die Bezeichnung McsB und spielt eine Rolle bei der Stressantwort des Bakteriums. Mit Stress – wie zum Beispiel Hitze – umzugehen, ist für alle Lebewesen eine große Herausforderung. Gerade Mikroorganismen haben dabei oft erstaunliche Strategien entwickelt. Bakterien, die in Zellen eindringen und Krankheiten auslösen, sind etwa umso virulenter je besser sie sich gegen Fieber wappnen können.
B. stearothermophilus selbst ist kein Krankheitserreger, kann aber Lebensmittel verderben. Der Organismus fühlt sich bei Temperaturen um 55 Grad am wohlsten. Das hat für die Forscher den Vorteil, dass seine Proteine sehr stabil sind und auch gröbere Untersuchungsmethoden überstehen.
Bei Hitzestress wird das Enzym McsB aktiv. Es überträgt einen Phosphatrest an ein Regulatorprotein namens CtsR, das normalerweise an DNA gebunden ist und dort das Ablesen von Stressgenen blockiert. Mit der Phosphorylierung ändern sich die Ladungsverhältnisse, die Bindung an die DNA geht verloren.
Was den Vorgang für die Wissenschaft so interessant macht: McsB hängt die Phosphatgruppe an die Aminosäure Arginin an und nicht wie sonst üblich an Serin, Threonin oder Tyrosin. Der Nachweis dafür war nicht leicht zu führen, für die Analyse von Phosphoarginin musste erst eine neue Methode entwickelt werden. Besonders hilfreich dabei war die enge Zusammenarbeit mit der IMP-IMBA Servicegruppe für Massenspektrometrie unter Karl Mechtler. Auch eine Arbeitsgruppe der Max F. Perutz Laboratories unter Emmanuelle Charpentier war an dem Projekt beteiligt – ein Beispiel für erfolgreiche interdisziplinäre Zusammenarbeit am Campus Vienna Biocenter.
Für den IMP-Doktoranden Jakob Fuhrmann, Erstautor der Publikation, ergeben sich aus der Arbeit spannende Zukunftsperspektiven. „Der neue und seltene Signalweg könnte medizinisch interessant werden, etwa als Angriffsziel für spezifisch wirkende Antibiotika“, erläutert Fuhrmann. Immerhin sind Krankheitserreger wie Staphylokokken und Listerien enge Verwandte des untersuchten Bazillus und besitzen die gleichen Stressgene.
In einem nächsten Schritt wollen die IMP-Forscher nun untersuchen, ob Protein Arginin-Kinasen auch beim Menschen vorkommen. Sollten sie exklusiv zur Ausstattung von Mikroorganismen zählen, wäre eine Intervention mit Medikamenten besonders gezielt und nebenwirkungsarm.
Über Tim Clausen
Der gebürtige Flensburger Tim Clausen absolvierte ein Biologiestudium an der Universität Konstanz. 1997 promovierte er an der Technischen Universität München und kehrte für seine Habilitation wieder nach Konstanz zurück. Ab 1999 leitete Tim Clausen für drei Jahre eine Arbeitsgruppe am Max Planck Institut für Biochemie in Martinsried. 2002 wechselte er an das Wiener Forschungsinstitut für Molekulare Pathologie (IMP), wo er eine neue Abteilung für Protein-Kristallographie aufbaute. Ab 1. Juli 2009 wird er die Position eines IMP Senior Scientists bekleiden.
Media Contact
Weitere Informationen:
http://www.imp.ac.at/research/tim-clausenAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Atomkern mit Laserlicht angeregt
Dieser lange erhoffte Durchbruch ermöglicht neuartige Atomuhren und öffnet die Tür zur Beantwortung fundamentaler Fragen der Physik. Forschenden ist ein herausragender Quantensprung gelungen – sprichwörtlich und ganz real: Nach jahrzehntelanger…

Wie das Immunsystem von harmlosen Partikeln lernt
Unsere Lunge ist täglich den unterschiedlichsten Partikeln ausgesetzt – ungefährlichen genauso wie krankmachenden. Mit jedem Erreger passt das Immunsystem seine Antwort an. Selbst harmlose Partikel tragen dazu bei, die Immunantwort…

Forschende nutzen ChatGPT für Choreographien mit Flugrobotern
Robotik und ChatGPT miteinander verbinden… Prof. Angela Schoellig von der Technischen Universität München (TUM) hat gezeigt, dass Large Language Models in der Robotik sicher eingesetzt werden können. ChatGPT entwickelt Choreographien…





















