Einmaliger Schnappschuss eines arbeitenden Enzyms
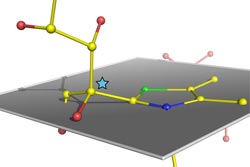
Atomare Struktur eines verbogenen, kurz vor der Spaltung stehenden Zuckermoleküls im humanen Enzym Transketolase. Der Stern markiert ein Kohlenstoffatom des Zuckers, das aus der eigentlich zu erwartenden Position innerhalb der grau definierten Ebene mehr als 20 Grad herausgehoben ist. Grafik: Universität Göttingen<br>
Enzyme sind die molekularen Katalysatoren des Lebens mit vitalen Funktionen im Stoffwechsel jeder Zelle. Bisher wurde spekuliert, dass Enzyme bei der Durchführung biochemischer Reaktionen ihre Ausgangsstoffe regelrecht verbiegen und dadurch spalten können.
Wissenschaftlern am Göttinger Zentrum für Molekulare Biowissenschaften (GZMB) ist es nun erstmals gelungen, diese Hypothese zweifelsfrei experimentell zu bestätigen. Die Ergebnisse der Studie sind in der renommierten Fachzeitschrift Nature Chemistry erschienen.
Die Göttinger Wissenschaftler unter der Leitung von Prof. Dr. Kai Tittmann und Prof. Dr. Ralf Ficner züchteten zunächst hochgeordnete Proteinkristalle des humanen Enzyms Transketolase, das eine Schlüsselrolle bei der Verwertung von Zuckern im menschlichen Stoffwechsel einnimmt. Diese Proteinkristalle versetzten sie mit den natürlichen Zuckersubstraten.
Die Analyse der Struktur des Enzymkristalls erfolgte anschließend an Teilchenbeschleunigern in Berlin und im französischen Grenoble. Den an dieser Studie maßgeblich beteiligten Wissenschaftlern des GZMB, Dr. Stefan Lüdtke und Dr. Piotr Neumann, gelang es, eine ultrahochaufgelöste Struktur des im Enzym gebundenen Zuckermoleküls unmittelbar vor seiner Spaltung in zwei Teile zu bestimmen. „Dieser in seiner Schärfe bis heute einmalige Schnappschuss eines arbeitenden Enzyms offenbart unzweifelhaft, dass das Zuckersubstrat im Enzym verbogen wird wie ein eingespanntes Werkstück in einem Schraubstock“, sagt Prof. Tittmann.
Enzyme stellen oft Angriffspunkte für Medikamente dar. Deshalb sind die neuen Erkenntnisse wichtig für die Entwicklung maßgeschneiderter, hochspezifischer Wirkstoffe, wie zum Beispiel für die Krebstherapie. „Auch die in der vorliegenden Studie untersuchte humane Transketolase übt eine Schlüsselfunktion im Stoffwechsel von Krebszellen aus“, sagt Prof. Tittmann.
Originalveröffentlichung: Stefan Lüdtke et al.: Sub-Ångström-resolution crystallography reveals physical distortions that enhance reactivity of a covalent enzymatic intermediate. Nature Chemistry. Doi: http://dx.doi.org/10.1038/nchem.1728
Kontaktadresse:
Prof. Dr. Kai Tittmann
Georg-August-Universität Göttingen
Fakultät für Biologie und Psychologie
Göttinger Zentrum für Molekulare Biowissenschaften (GZMB)
Ernst-Caspari-Haus, Justus-von-Liebig-Weg 11, 37077 Göttingen
Telefon (0551) 39-14430
E-Mail: kai.tittmann@biologie.uni-goettingen.de
Media Contact
Weitere Informationen:
http://www.uni-goettingen.de/de/sh/198266.htmlAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Atomkern mit Laserlicht angeregt
Dieser lange erhoffte Durchbruch ermöglicht neuartige Atomuhren und öffnet die Tür zur Beantwortung fundamentaler Fragen der Physik. Forschenden ist ein herausragender Quantensprung gelungen – sprichwörtlich und ganz real: Nach jahrzehntelanger…

Wie das Immunsystem von harmlosen Partikeln lernt
Unsere Lunge ist täglich den unterschiedlichsten Partikeln ausgesetzt – ungefährlichen genauso wie krankmachenden. Mit jedem Erreger passt das Immunsystem seine Antwort an. Selbst harmlose Partikel tragen dazu bei, die Immunantwort…

Forschende nutzen ChatGPT für Choreographien mit Flugrobotern
Robotik und ChatGPT miteinander verbinden… Prof. Angela Schoellig von der Technischen Universität München (TUM) hat gezeigt, dass Large Language Models in der Robotik sicher eingesetzt werden können. ChatGPT entwickelt Choreographien…





















