Ein Blumenstrauß aus Proteinen – Moleküle in der Nanowelt des Körpers

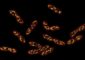
Vier VASP-Proteine und ihre verschiedenen Aktin-Bindungspartner. Dieses Modell haben Forscher aus Würzburg und Dortmund entwickelt, nachdem sie die Struktur desjenigen VASP-Abschnitts aufgeklärt hatten, der für die Entstehung einer funktionsfähigen Überstruktur aus vier einzelnen VASP-Proteinen unabdingbar ist. Grafik nach: PNAS 101 (49): 17027-17032, 7. Dezember 2004
Ob Wundheilung, Blutstillung, Entzündungen oder die Ausbreitung von Krebszellen im Organismus – bei all diesen Prozessen spielen Zellbewegungen eine Rolle, an denen ein Protein namens VASP beteiligt ist. Forscher von der Uni Würzburg haben mit Kollegen aus Dortmund nun eine besonders wichtige Teilstruktur dieses Proteins aufgeklärt. Die Details sind in der US-Zeitschrift PNAS beschrieben.
Der Stellenwert von VASP („Vasodilator-Stimuliertes Phosphoprotein“) offenbart sich dann am besten, wenn das Protein gestört ist. Fehlt es ganz, dann funktionieren etwa die für die Blutgerinnung wichtigen Blutplättchen nicht mehr richtig.
Für die verlässliche biologische Arbeitsleistung eines Proteins ist dessen dreidimensionale Struktur ausschlaggebend. Darum arbeiten weltweit viele Forscher daran, die Gestalt von Proteinen zu bestimmen. So auch die Gruppe von Professor Ulrich Walter am Institut für Klinische Biochemie und Pathobiochemie der Uni Würzburg und die Dortmunder Strukturbiologen um Professor Alfred Wittinghofer vom Max-Planck-Institut für Molekulare Physiologie.
Den Würzburger Forschern war seit langem bekannt, dass sich vier VASP-Proteine zusammenlagern müssen, um im Körper des Menschen richtig funktionieren zu können. Nun haben sie herausgefunden, dass für die Entstehung dieser Überstruktur die letzten 45 Aminosäuren des Proteins verantwortlich sind: Wenn dieser Teil fehlt, bleiben die einzelnen VASP-Moleküle für sich alleine.
Die dreidimensionale Struktur dieses wichtigen Proteinabschnitts von VASP wurde nun experimentell bestimmt. Er besteht aus vier spiralig miteinander verwundenen Aminosäureketten, die ihrerseits selbst wieder eine spiralförmige Raumstruktur haben. Dabei identifizierten die Forscher erstmalig ein bestimmtes Aminosäuremuster, dessen Existenz bereits 1953 von dem Chemie- und späteren Friedensnobelpreisträger Linus Pauling (1901 – 1994) vorhergesagt worden war. Auch gelang ihnen ein erster Einblick in die bislang unbekannte Gestalt des Gesamtmoleküls.
„Der vollständige Komplex aus den vier VASP-Molekülen ist demnach aufgebaut wie ein verkleinerter Blumenstrauß, der an einem Ende wie von unsichtbarer Hand zusammengehalten wird“, erklärt Professor Walter. Diese Anordnung sei ideal zur Kontaktaufnahme mit anderen Molekülen. Das können zum Beispiel einzelne Aktin-Proteinfasern sein, die dann durch VASP in eine bestimmte Richtung zusammengebündelt und verlängert werden können. Solche und andere Proteinfasern treten im Zellskelett auf. Dieses Stütz- und Kabelsystem spielt bei Bewegungsprozessen der Zelle, an denen VASP nachweislich beteiligt ist, eine wichtige Rolle.
Die jetzt veröffentlichten Ergebnisse haben bezüglich der molekularen Funktion von VASP zu neuen Hypothesen geführt, welche die Würzburger Forscher nun experimentell überprüfen wollen. Die hier beschriebenen Arbeiten wurden von der Deutschen Forschungsgemeinschaft im Sonderforschungsbereich (SFB) 355 finanziell gefördert. Die Erkenntnis über die Blumenstrauß-Struktur von VASP stammt aus einem Projekt, das von Dr. Thomas Jarchau geleitet wurde.
VASP wurde 1987 in der Arbeitsgruppe von Ulrich Walter als neues Zielprotein in Blutplättchen und anderen Zellen des Blutgefäßsystems entdeckt. 1995 klärten die Würzburger dann die Aminosäure-Sequenz von VASP auf. Es besteht aus 380 Aminosäuren und entpuppte sich in der Folge als das erste Mitglied einer völlig neuen Proteinfamilie. Die Teilstruktur einer weiteren wichtigen VASP-Domäne wurde im Jahr 2000 von der Würzburger Gruppe in Zusammenarbeit mit Strukturbiologen vom Forschungsinstitut für Molekulare Pharmakologie in Berlin beschrieben.
Weitere Informationen:
Dr. Thomas Jarchau
T (0931) 201-45136
Fax (0931) 201-45153
E-Mail: jarchau@klin-biochem.uni-wuerzburg.de
Karin Kühnel, Thomas Jarchau, Eva Wolf, Ilme Schlichting, Ulrich Walter, Alfred Wittinghofer und Sergei V. Strelkov: „The VASP tetramerization domain is a right-handed coiled coil based on a 15-residue repeat“, PNAS (Proceedings of the National Academy of Sciences of the USA) 101(49): Seiten 17027 – 17032, 7. Dezember 2004
Media Contact
Weitere Informationen:
http://www.uni-wuerzburg.deAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Wie die Galvanotechnik durch Digitalisierung effizient wird
SurfaceTechnology GERMANY… Digitalisierung und Hartverchromung aus Chrom(III)-Elektrolyten: Das sind die beiden großen Themen, mit denen sich Forscherinnen und Forscher von der Abteilung Galvanotechnik am Fraunhofer IPA derzeit beschäftigen. Ihre Erkenntnisse…

Ersatz für Tierversuche – jetzt ganz ohne Tierleid
Erstes Gewebe-Modell der Leber völlig ohne Materialien tierischer Herkunft hergestellt. Wissenschaftler*innen der TU Berlin haben mit Hilfe von 3D-Biodruck erstmals ein Modell der Leber aus menschlichen Zellen hergestellt, ohne dabei…
Neue Wege zur mentalen Gesundheit
Magnetspule am Kopf sorgt für antidepressive Effekte… In der Klinik und Poliklinik für Psychiatrie und Psychotherapie am Universitätsklinikum Bonn (UKB) wird derzeit eine Studie zur Erforschung der antidepressiven Wirkung einer…