Alzheimerforschung: Toxische Proteinklümpchen können eigenen Abbau verhindern
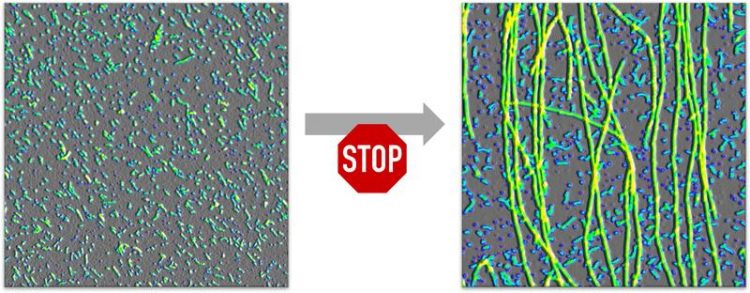
Oligomere (links) verhindern aktiv, dass sie zu Fibrillen (Fäden im rechten Bild) abgebaut werden. Abbildung: Wolfgang Hoyer / HHU
Oligomere sind Aggregate aus wenigen Protein-Molekülen, im Falle der Alzheimer-Demenz beispielsweise des Proteins Amyloid-beta (Aβ). Neben Oligomeren können aus diesen Proteinen auch größere Strukturen entstehen, die Fibrillen und schließlich Plaques, die sich aus Fibrillen bilden.
Alle diese Stoffe sind giftig für Nervenzellen. Es ist bekannt, dass die Oligomere am gefährlichsten sind, da sie schon in besonders kleinen Mengen Nervenzellen schädigen oder sogar töten.
Die Düsseldorfer und Jülicher Forscher um Dr. Wolfgang Hoyer vom HHU-Institut für Physikalische Biologie untersuchten zusammen mit Kollegen von der University of South Florida, wie Oligomere entstehen und wie sie im Laufe der Zeit zu Fibrillen abgebaut werden.
Dabei stellte sich heraus, dass sich Oligomere und Fibrillen unabhängig voneinander bilden und beide um den gleichen Vorrat von Amyloid-beta-Proteinbausteinen konkurrieren. Die Oligomere sind zwar kurzlebiger als die Fibrillen und zerfallen nach gewisser Zeit wieder in ihre Bestandteile. Die Forscher fanden aber heraus, dass die Oligomere aktiv die Bildung der Fibrillen stören, sich also selbst vor dem Abbau schützen können.
Dr. Hoyer zu den weiterreichenden Konsequenzen der Studie: “Unsere Ergebnisse geben einen Erklärungsansatz, warum die Schwere einer Alzheimer-Demenz nur wenig mit der Menge an Plaques zusammenhängt.
Die klinische Symptomatik kann vielmehr mit der Menge der Oligomere korreliert sein.” Entsprechend wären auch die Oligomere ein vorrangiges Ziel für die Wirkstoffentwicklung bei der Alzheimertherapie.
Originalveröffentlichung
Filip Hasecke, Tatiana Miti, Carlos Perez, Jeremy Barton, Daniel Schölzel, Lothar Gremer, Clara S. R. Grüning, Garrett Matthews, Georg Meisl, Tuomas P. J. Knowles, Dieter Willbold, Philipp Neudecker, Henrike Heise, Ghanim Ullah, Wolfgang Hoyer and Martin Muschol, Origin of metastable oligomers and their effects on amyloid fibril self-assembly, Chemical Science, 13.06.2018
DOI: 10.1039/c8sc01479e
Media Contact
Weitere Informationen:
http://www.hhu.de/Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Robotisch assistiertes Laserverfahren soll OP-Risiken minimieren
Eine Spinalkanalstenose – eine knöcherne Verengung des Wirbelkanals – kann für Betroffene zur Qual werden. Drückt sie auf das Rückenmark, drohen ihnen chronische Schmerzen und Lähmungserscheinungen. Häufig hilft dann nur…

Verbesserte Materialien für die Verbindungen von Mikrochips
Leistungsfähiger, stromsparender, komplexer – Hersteller von modernen Microchips sehen sich stetig neuen Herausforderungen gegenüber, auch in Bezug auf die dort notwendigen elektrischen Verbindungen. Das Fraunhofer IPMS und BASF widmen sich…

Inspiriert von der Natur: Biophysiker aus dem Projekt InCamS@BI entwickelt neuartige Mikroplastikfilter im Labor
Heutzutage ist es überall zu finden: Mikroplastik. Es wird insbesondere durch die Luft und durchs Wasser in die entlegensten Winkel der Erde transportiert. Eine der großen Fragen lautet: Wie können…



