Wie Zellen ihren Müll entsorgen
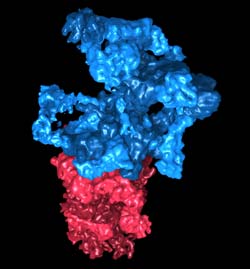
Rekonstruktion des 26S-Proteasoms: Das „Regulatorische Partikel“ (blau) erkennt die mit Ubiquitin markierten Proteine und bereitet sie für den Abbau vor. Das Kernpartikel (rot) zerlegt die Proteine in ihre Bestandteile. Grafik: Julio Ortiz / Copyright: MPI für Biochemie<br>
Werden fehlerhafte Proteine nicht vom Körper abgebaut, können sie Krankheiten wie Alzheimer oder Parkinson verursachen. Wissenschaftlern am Max-Planck-Institut (MPI) für Biochemie ist es kürzlich gelungen, die Struktur der zellulären Proteinabbau-Maschinerie (26S-Proteasom) mit Hilfe einer Kombination aus verschiedenen strukturbiologischen Methoden aufzuklären.
Die Ergebnisse des Gemeinschaftsprojekts mit Kollegen der University of California San Francisco und der Eidgenössischen Technischen Hochschule Zürich sind ein wichtiger Schritt für die weitere Erforschung des 26S-Proteasoms. Sie wurden jetzt in Proceedings of the National Academy of Sciences PNAS veröffentlicht.
In einer Zelle dürfen zu einem bestimmten Zeitpunkt ihrer Entwicklung nur die Proteine vorhanden sein, die sie gerade benötigt. Andernfalls können unerwünschte Reaktionen auftreten, die beispielsweise zu Krebs führen können. Außerdem müssen die Proteine die korrekte Form aufweisen, um ihre Aufgaben erfüllen zu können. Sind sie falsch gefaltet, können sie verklumpen und neurodegenerative Krankheiten wie Alzheimer oder Parkinson die Folge sein. Um das zu verhindern, verfügt der Körper über verschiedene Mechanismen, die den Proteinhaushalt regulieren und wenn nötig Proteine abbauen.
Eine zentrale Rolle beim Proteinabbau spielt die „zelluläre Müllabfuhr“, das 26S-Proteasom. Fehlgefaltete und potentiell gefährliche Proteine werden zunächst mit dem zellulären Etikett Ubiquitin verknüpft. Das 26S-Proteasom erkennt die markierten Proteine und zerlegt sie in ihre Bestandteile, die dann wiederverwertet werden. Seine Struktur konnten Wissenschaftler um Wolfgang Baumeister, Leiter der Forschungsabteilung Molekulare Strukturbiologie am MPI für Biochemie, jetzt entschlüsseln.
Viele Puzzleteile führen zur Struktur
„Die Struktur des 26S-Proteasoms ändert sich laufend“, erklärt Friedrich Förster, Leiter der Forschungsgruppe Modellierung von Proteinkomplexen am MPI für Biochemie. „Daher konnte sie mit Hilfe traditioneller Ansätze wie etwa der Röntgenkristallographie allein bisher nicht aufgeklärt werden. Erst die Kombination verschiedener Methoden brachte den Erfolg.“ Die Elektronenmikroskopie und die Massenspektrometrie halfen dabei, den groben Aufbau des 26S-Proteasoms zu entschlüsseln. Die Röntgenkristallographie gewährte detaillierte Einblicke in einzelne Bereiche des Moleküls. Am Computer setzten die Forscher die unterschiedlichen Daten dann zu einem Gesamtbild zusammen.
Basierend auf diesen Ergebnissen wollen die Forscher künftig untersuchen, wie die verschiedenen Mechanismen des Proteinabbaus funktionieren. „Wir haben bereits eine Hypothese entwickelt, wie genau das 26S-Proteasom markierte Proteine erkennt und weiterverarbeitet“, so Stefan Bohn, Wissenschaftler am MPI für Biochemie. Die vollständige Aufklärung des 26S-Proteasoms und der zugrunde liegenden Mechanismen könnte auch von medizinischer Bedeutung sein: Die „zelluläre Müllabfuhr“ ist ein denkbarer therapeutischer Ansatzpunkt bei Krebs und neurodegenerativen Krankheiten.
Originalveröffentlichungen:
Lasker, K. et al.: Molecular architecture of the 26S proteasome holocomplex determined by an integrative approach.
Proc. Natl. Acad. Sci. USA, 24. Januar 2012.DOI: 10.1073/pnas.1120559109.
Pathare, G. R. et al.: The proteasomal subunit Rpn6 is a molecular clamp holding the core and regulatory subcomplexes together.
Proc. Natl. Acad. Sci. USA, 03. Januar 2012.
DOI: 10.1073/pnas.1117648108.
Sakata, E. et al.: Localization of the proteasomal ubiquitin receptors Rpn10 and Rpn13 by electron cryomicroscopy. Proc. Natl. Acad. Sci. USA, 3. Januar 2012. DOI: 10.1073/pnas.1119394109.
Kontakt:
Prof. Dr. Wolfgang Baumeister
Molekulare Strukturbiologie
Max-Planck-Institut für Biochemie
Am Klopferspitz 18
82152 Martinsried
E-Mail: baumeist@biochem.mpg.de
www.biochem.mpg.de/baumeister
Anja Konschak
Öffentlichkeitsarbeit
Max-Planck-Institut für Biochemie
Am Klopferspitz 18
82152 Martinsried
Tel.: +49 (0) 89 8578-2824
E-Mail: konschak@biochem.mpg.de
Media Contact
Weitere Informationen:
http://www.biochem.mpg.deAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Das Mikrobiom verändert sich dynamisch und begünstigt wichtige Funktionen für den Wirt
Ein interdisziplinäres Forschungsteam des Kieler SFB 1182 untersucht am Beispiel von Fadenwürmern, welche Prozesse die Zusammensetzung des Mikrobioms in Wirtslebewesen steuern. Alle vielzelligen Lebewesen – von den einfachsten tierischen und…

Wasser im Boden – genaue Daten für Landwirtschaft und Klimaforschung
Die PTB präsentiert auf der Woche der Umwelt, wie sich die Bodenfeuchte mithilfe von Neutronenstrahlung messen lässt. Die Bodenfeuchte hat nicht nur Auswirkungen auf die Landwirtschaft, sondern ist als Teil…

Bioreaktor- und Kryotechnologien für bessere Wirkstofftests mit humanen Zellkulturen
Medizinische Wirkstoffforschung… Viele Neuentwicklungen von medizinischen Wirkstoffen scheitern, weil trotz erfolgreicher Labortests mit Zellkulturen starke Nebenwirkungen bei Probanden auftreten. Dies kann passieren, wenn zum Beispiel die verwendeten Zellen aus tierischem…





















