Durchbruch in der Leukämie-Forschung

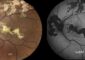
Das Adapterprotein SLP-65 bindet an mehrere intrazelluläre Signalproteine ( BTK, PLCy, Grb2) und organisiert diese zu einem größeren Signalproteinkomplex, das Signalosom. Innerhalb dieses Komplexes können intrazellulärer Signale, welche die Differenzierung der prä-B Zellen steuern, schnell verschaltet und sicher reguliert werden. <br>1B: Fehlt das Adapterprotein SLP-65, kommt es zu einer fehlerhaften Signalverschaltung und zum Block der prä-B-Zelldifferenzierung. Gleichzeitig verlieren intrazelluläre Signalproteine ihre regulierende Wirkung und es kommt zu einer verstärkten Vermehrung der prä-B-Zellen, die dann zu unkontrolliert wachsenden Tumorzellen entarten können. <br> <br>Foto: Max-Planck-Institut für Immunbiologie <br>
Max-Planck-Forscher entdecken, dass die Akute Lymphatische Leukämie (ALL) bei Kindern durch das Fehlen eines speziellen Proteins infolge fehlerhafter Genablesung verursacht wird. Leukämien sind bösartige Erkrankungen des Knochenmarks, bei denen unreife Vorläuferzellen der weißen Blutkörperchen entarten und sich dann unkontrolliert vermehren. Bei etwa 80 Prozent der Leukämien im Kindes- und Jugendalter handelt es sich um die Akute Lymphatische Leukämie (ALL). Dabei verdrängt die ungehemmte Teilung der funktionsuntüchtigen Vorläuferzellen die normalen blutbildenden Zellen und die Entstehung normal funktionierender roter und weißer Blutkörperchen und Blutplättchen wird mehr und mehr vermindert. Bisher war nicht bekannt, wie es zu diesem Verlust der Wachstumskontrolle in den Vorläuferzellen kommt.
Wissenschaftler des Max-Planck-Instituts für Immunbiologie und der Universität Freiburg haben jetzt entdeckt, dass bei etwa 50 Prozent dieser Tumor-Erkrankungen ein bestimmtes Protein, das Adapterprotein SLP-65, nicht mehr hergestellt wird. Am Modell der Maus sowie an menschlichen Zellen konnten sie nachweisen, dass der Verlust des SLP-65 zu einem verstärkten Wachstum der weißen Blutzellen und zur Tumorbildung führt. Diese Ergebnisse wurden am 22. Mai 2003 in der Fachzeitschrift „Nature“ veröffentlicht.
B-Zellen sind ein wichtiger Teil unseres Immunsystems – sie produzieren Antikörper, die uns vor Infektionen schützen. B-Zellen werden in unserem Körper ständig und in großen Mengen aus so genannten Stammzellen und Vorläufer B-Zellen (prä-B-Zellen) gebildet. Die dafür typische häufige Zellteilung macht diese Zellen besonders anfällig für Entartungen, die zu Tumoren (Leukämien) führen können. Die prä-B-Zell Akute Lymphatische Leukämie (prä-B-ALL) ist die am häufigsten vorkommende Leukämie bei Kindern. Bisher hatte man angenommen, dass diese Leukämie durch Veränderungen im Genom der Vorläuferzellen entsteht. Doch diese Veränderungen sind nicht in allen Fällen nachweisbar und könnten auch erst nach der Entartung der Vorläuferzellen entstanden sein.
Ein Forscherteam um Dr. Hassan Jumaa und Dr. Michael Reth vom Institut für Biologie III der Universität Freiburg und dem Max-Planck-Institut für Immunbiologie in Freiburg haben jetzt herausgefunden, dass in bis zu 50 Prozent der prä-B-ALL Tumore das Adapterprotein SLP-65 fehlt. Dieses Protein kommt normalerweise in allen B-Zellen vor und spielt eine wichtige Rolle bei der Signalleitung vom B-Zell-Antigenrezeptor. Adapterproteine sind Gerüstproteine, die mehrere intrazelluläre Signalproteine zu einem größeren Proteinkomplex zusammenfassen, um die schnelle Verarbeitung intrazellulärer Signale zu ermöglichen. Der vom Adapterprotein SLP-65 aufgebaute Proteinkomplex reguliert die weitere Entwicklung der B-Zellen. Die Forscher stellten nun fest, dass bei Mäusen, denen das SLP-65 Gen fehlt, die Entwicklung der B-Zellen blockiert wird. Doch überraschend fanden die Forscher bei einem Teil dieser SLP-65-defizienten Mäuse nicht nur einen Entwicklungsstopp der prä-B-Zellen, sondern auch leukämieartige prä-B-Zell-Tumore. Die Forscher führten daraufhin das Gen für dieses Protein wieder in die entarteten B-Zellen ein und konnten so das Entstehen der prä-B-Zell-Leukämie in diesen Mäusen verhindern. SLP-65 fördert also nicht nur die B-Zellreifung, sondern verhindert auch ein unkontrolliertes Wachstum dieser Vorläuferzellen. Von daher handelt es sich um ein bisher noch nicht bekanntes Tumorsuppressor-Gen.
Nach dieser überraschenden Entdeckung fragten sich die Freiburger Max-Planck-Forscher, ob das SLP-65-Gen möglicherweise auch eine Rolle bei menschlichen B-Zell-Leukämien spielen könnte. Sie untersuchten deshalb in Zusammenarbeit mit Kinderkliniken in Freiburg (Dr. C. Niemeyer), Hannover (Dr. M. Schrappe), Zürich, Hamburg und Kuopio (Dr. Pelkonen, Finnland) eine Vielzahl von Leukämie-Proben des Typs prä-B-ALL von zumeist jungen Patienten. Sie stellten dabei fest, dass tatsächlich in fast der Hälfte dieser prä-B-ALL-Tumore das Adaptorprotein SLP-65 fehlte.
Doch wie kann es dazu kommen, dass diese Vorläuferzellen das Adapterprotein nicht mehr produzieren? Auch hier fanden die Forscher die Ursache: Die meisten Gene des Menschen sind in Genfragmente, so genannte Exone, unterteilt. Bevor von diesem Gen ein Produkt, also ein Protein, hergestellt werden kann, muss die Geninformation erst einmal in eine Ribonukleotidsäure (RNS) umgeschrieben werden. Dazu werden zuvor die einzelnen Exone dieses Gens in einem Prozess, den man „Splicing“ nennt, zu einer kompletten Boten-RNS (mRNS) zusammengefügt. Das Gen für das Adapterprotein SLP-65 besteht aus insgesamt 17 Exonen, die während der RNS-Prozessierung zu einem Leseraster zusammengefasst werden müssen.
Die Forscher stellten nun in den kranken Vorläuferzellen fest, dass sich zwischen dem Exonen 3 und 4 dieses Gens weitere so genannte alternative Exone (3a und 3b) befinden. Werden diese alternativen Exone in die RNS für das SLP-65-Protein eingebaut, wird das Leseraster dieses Proteins unterbrochen, so dass sich kein funktionstüchtiges SLP-65-Protein mehr bilden kann. Derart veränderte RNS-Moleküle haben die Forscher zu einem kleinen Teil auch in gesunden B-Zellen des Menschen gefunden. Doch in den prä-B-ALL-Tumoren ist diese veränderte RNS-Prozessierungen dominant und verhindert generell die Produktion des SLP-65-Proteins.
In den weiteren Forschungsarbeiten geht es jetzt darum zu klären, was die Ursache für diese Veränderung der RNS-Prozessierung in den prä-B-Zellen ist. Die Forscher vermuten, dass hierbei Viren im Spiel sind. Viren benutzen oft die alternative RNS-Prozessierung zur Ausprägung ihrer Gene in der Wirtszelle und könnten mittels viraler Proteine auch in die RNS-Prozessierung menschlicher Gene eingreifen. Doch welche der vielen Viren, an denen wir hauptsächlich während unserer Kindheit erkranken, die prä-B-ALL-Leukämie tatsächlich auslösen, ist zur Zeit nicht bekannt.
Media Contact
Weitere Informationen:
http://www.mpg.de/pri03/pri0357.htmAlle Nachrichten aus der Kategorie: Medizin Gesundheit
Dieser Fachbereich fasst die Vielzahl der medizinischen Fachrichtungen aus dem Bereich der Humanmedizin zusammen.
Unter anderem finden Sie hier Berichte aus den Teilbereichen: Anästhesiologie, Anatomie, Chirurgie, Humangenetik, Hygiene und Umweltmedizin, Innere Medizin, Neurologie, Pharmakologie, Physiologie, Urologie oder Zahnmedizin.
Neueste Beiträge

Neue universelle lichtbasierte Technik zur Kontrolle der Talpolarisation
Ein internationales Forscherteam berichtet in Nature über eine neue Methode, mit der zum ersten Mal die Talpolarisation in zentrosymmetrischen Bulk-Materialien auf eine nicht materialspezifische Weise erreicht wird. Diese „universelle Technik“…

Tumorzellen hebeln das Immunsystem früh aus
Neu entdeckter Mechanismus könnte Krebs-Immuntherapien deutlich verbessern. Tumore verhindern aktiv, dass sich Immunantworten durch sogenannte zytotoxische T-Zellen bilden, die den Krebs bekämpfen könnten. Wie das genau geschieht, beschreiben jetzt erstmals…

Immunzellen in den Startlöchern: „Allzeit bereit“ ist harte Arbeit
Wenn Krankheitserreger in den Körper eindringen, muss das Immunsystem sofort reagieren und eine Infektion verhindern oder eindämmen. Doch wie halten sich unsere Abwehrzellen bereit, wenn kein Angreifer in Sicht ist?…