Bauanleitung für eine molekulare Nase
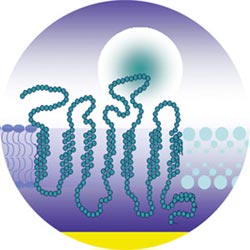
<br>Schematische Darstellung einer synthetischen Membran, die ein Geruchsrezeptormolekül - hier als lange Kette gezeichnet - enthält. An den Geruchsrezeptor bindet ein kugelförmiges Geruchsmolekül. Der linke Teil der Membran besteht aus Lipidmolekülen, der rechte aus einem Blockcopolymer. In Zukunft könnte dieses Polymer die Lipide ersetzen - die Membran wäre dadurch luftstabil. Bild: Max-Planck-Institut für Polymerforschung
Eine künstliche Nase wäre manchmal eine Hilfe: Solch ein Biosensor könnte Gifte, Sprengstoff oder Drogen erschnuppern. Nun haben Forscher des Max-Planck-Instituts für Polymerforschung und des Max-Planck-Instituts für Biochemie eine Bauanleitung vorgelegt, wie sich Membranproteine in künstliche Strukturen einbetten lassen. Membranproteine übernehmen in Zellen vielfältige und wichtige Aufgaben. Unter anderem dienen sie als Rezeptoren, die Signale etwa von Molekülen in der Luft in das Zellinnere weiterleiten. Membranproteine sind also ideale Biosensoren, waren aber im Labor bislang schwer zugänglich. Den Max-Planck-Wissenschaftlern gelang es nun, durch zellfreie Proteinsynthese hergestellte Membranproteine direkt in künstliche Lipidmembranen einzubetten (Angewandte Chemie, International Edition, 15. Januar 2007).
Die Sinne der Lebewesen arbeiten mit verschiedenen Mechanismen: Unter anderem nutzen sie Membranproteine als Rezeptoren. Nun haben Wissenschaftler des Max-Planck-Instituts für Polymerforschung und des Max-Planck-Instituts für Biochemie Biosensoren konstruiert, indem sie solche Proteine in künstliche Strukturen eingebunden haben. Die zellfreie Proteinsynthese lieferte ihnen dabei die Membranproteine – direkt aus der genetischen Information, die dem Zellextrakt hinzugefügt wurde.
Die Versuche, Biosensoren aus Membranproteinen herzustellen, scheiterten an den besonderen Eigenschaften dieser Proteine. Sie sind nämlich nicht wasserlöslich. Bislang versuchten Forscher die Proteine erst einmal mit Detergentien aus ihrer Membran herauslösen. Dabei zerstören sie allerdings die besondere Faltstruktur der Proteinmembranen – und genau diese Struktur macht die spezielle Funktion der Proteine aus. „Wir stellten sehr schnell fest, wie kompliziert solche Membranproteine zu handhaben sind. Mit herkömmlichen Methoden bekamen wir – und auch andere Gruppen – sie einfach nicht in den Griff“, erzählt Dr. Eva-Kathrin Sinner vom Mainzer Max-Planck-Institut für Polymerforschung.
Die Max-Planck-Wissenschaftler fanden nun einen Ausweg. Sie schafften es, die Proteine in eine künstliche Matrix einzubauen und zwar so, als befände sie sich in einer natürlichen Zellmembran: Die Wissenschaftler boten den entstehenden Membranproteinen schon während ihrer Herstellung künstliche Lipidmembransysteme an, die natürlichen Zellmembranen ähnelten. Und tatsächlich lagerten sich die Membranproteine – die Forscher benutzten bei ihren Versuchen Geruchsrezeptoren der Wanderratte aus der Klasse der G-Protein-gekoppelten Rezeptoren – in die künstlichen Membranen ein. Dass die Geruchsrezeptoren auch wirklich biologisch aktiv sind, konnten die Wissenschaftler durch die Bindung von Geruchsstoffen an die Rezeptoren nachweisen. „Wir haben jetzt praktisch eine Gebrauchsanweisung, wie man bisher schwer zugängliche Membranproteine in ihrer aktiven Struktur herstellen und untersuchen kann“, so Sinner.
Das neue Verfahren der Gruppe um Eva-Kathrin Sinner ermöglicht erstmals die natürlichen Funktionen solcher Membranproteine in situ zu untersuchen. Für die Pharmaforschung ist dieser Ansatz von großer Bedeutung, da so neue Wirkstoffscreenings an Rezeptoren durchgeführt werden können, die bislang noch nicht zugänglich waren. Sinner wurde für die Entwicklung dieses Verfahrens mit dem Forschungspreis 2007 zur Förderung der Biotechnologie und Gentechnik der Engelhorn-Stiftung ausgezeichnet.
Originalveröffentlichung:
R. Robelek, E. S. Lemker, B. Wiltschi, V. Kirste, R. Naumann, D. Oesterhelt, E.-K. Sinner, Incorporation of in vitro Synthesized GPCR into a Tethered Artificial Lipid Membrane System, Angewandte Chemie, International Edition, 15. Januar 2007
Media Contact
Weitere Informationen:
http://www.mpg.deAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Diamantstaub leuchtet hell in Magnetresonanztomographie
Mögliche Alternative zum weit verbreiteten Kontrastmittel Gadolinium. Eine unerwartete Entdeckung machte eine Wissenschaftlerin des Max-Planck-Instituts für Intelligente Systeme in Stuttgart: Nanometerkleine Diamantpartikel, die eigentlich für einen ganz anderen Zweck bestimmt…

Neue Spule für 7-Tesla MRT | Kopf und Hals gleichzeitig darstellen
Die Magnetresonanztomographie (MRT) ermöglicht detaillierte Einblicke in den Körper. Vor allem die Ultrahochfeld-Bildgebung mit Magnetfeldstärken von 7 Tesla und höher macht feinste anatomische Strukturen und funktionelle Prozesse sichtbar. Doch alleine…

Hybrid-Energiespeichersystem für moderne Energienetze
Projekt HyFlow: Leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem für moderne Energienetze. In drei Jahren Forschungsarbeit hat das Konsortium des EU-Projekts HyFlow ein extrem leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem entwickelt, das einen…





















