Kalzium-Imaging bringt das Gehirn zum Leuchten
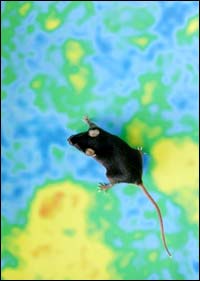
Eine mit einem Kalzium-Indikator (Camgaroo-2) versehene transgene Maus bewegt sich auf einer Kalzium-Aktivitätskarte des Riechhirns, die nach Geruchsstimulation aufgenommen wurde. <br>Bild: Max-Planck-Institut für medizinische Forschung
Heidelberger Max-Planck-Forscher präsentieren neue Methode, mit der man die biochemische Aktivität verschiedener Nervenzellen im Gehirn gleichzeitig beobachten kann
Wenn man die Aktivität neuronaler Schaltkreise im Gehirn beobachten will, so nutzte man bisher vor allem die elektrische Ableitung mit Mikroelektroden (patch-clamp-Technik). Doch diese Methode stößt an ihre Grenzen, will man Zellaktivitäten an vielen Stellen im Gehirn gleichzeitig erfassen. Wissenschaftler des Max-Planck-Instituts für medizinische Forschung in Heidelberg ist es jetzt – gemeinsam mit Kollegen der Universität Heidelberg, der University of California in San Diego/USA sowie dem Brain Research Institute (RIKEN) in Saitama/Japan – erstmals gelungen, Nervenzellen in einem Säugetiergehirn (Maus) mit einer opto-physiologischen Methode zu beobachten. Diese beruht auf fluoreszierenden Kalziumindikator-Proteinen, deren Sequenz in das Genom der Mäuse eingebaut wird. Die Expression eines funktionellen Indikators wie der Kalzium-Dynamiker möglicht eine wesentlich höhere zeitliche und räumliche Auflösung als bisherige nicht-invasive Methoden, wie funktionelles Magnetresonanz-Imaging (fMPI) oder Positronen-Emissionstomographie (PET). In Kombination mit dem Zwei-Photonen-Imaging besteht jetzt die Möglichkeit, Kalzium-Signale an vielen Stellen im Nervengewebe und sogar innerhalb der Fortsätze einzelner Nervenzellen zu beobachten – in vitro und in vivo. Diese Methode könnte helfen zu verstehen, auf welche Weise einzelne Gene am Aufbau bzw. der erfahrungsabhängigen Veränderung von Schaltkreisen im Gehirn beteiligt sind (PloS Biology, 15. Juni 2004).
Der menschliche Körper besteht zu zwei Prozent aus Kalzium; wovon 99 Prozent in Knochen und Zähnen gebunden ist. Das restliche, in und zwischen den Zellen befindliche Kalzium ist an vielerlei zellulären Prozessen beteiligt, von der Transkription über die Signalverarbeitung bis hin zur Muskelkontraktion. Zwischen dem extrazellulärem Raum und dem Zellinneren existiert ein Kalziumgradient, wobei die extrazelluläre Kalziumkonzentration mehrere Tausend Mal größer ist als die in der Zelle. Um diesen Kalziumgradienten aufrecht zu erhalten, braucht die Zelle Kalziumpumpen. Kalzium-basierte Signalverarbeitung wird meist von spannungsgesteuerten oder durch Botenstoffe aktivierten Ionenkanälen vermittelt, die sich in der Zellmembran oder den die Organellen umschließende Membranen befinden.
Die (kalzium-basierte) Signalverarbeitung beginnt normalerweise mit einem Kalziumeinstrom durch die Zellmembran oder der Freisetzung von Kalzium aus Zellorganellen, wie z.B. dem Endoplasmatischen Retikulum. Bei der Kommunikation zwischen Nervenzellen müssen elektrische Signale in chemische Signale umgewandelt werden; hierzu werden chemische Botenstoffe (Neurotransmitter) in den Nervenendigungen vorrätig gehalten. Erreicht ein elektrisches Signal eine Nervenendigung, so öffnen sich dort viele spannungsgesteuert Kanäle, durch die Kalzium rasch in die Zelle einströmt. Die intrazelluläre Kalziumkonzentration erhöht sich und bewirkt auf diese Weise die Freisetzung eines Neurotransmitters – das elektrische Signal wurde also in ein chemisches umgewandelt. Bei der nachfolgenden Nervenzelle führt die Bindung des Neurotransmitters an spezifische Rezeptoren zu einer Änderung des Membranpotentials; hierdurch wird das chemische Signal wieder in ein elektrisches zurückverwandelt – der (Schalt)Kreis schließt sich.
Mindestens ebenso wichtig sind die postsynaptischen Prozesse, mit Hilfe derer elektrische Signale (synaptische oder Aktionspotentiale) in biochemische Informationen übersetzt werden, ein Vorgang, der z.B. für das Auslösen von synaptischer Plastizität notwendig ist. Auch hier spielt die Kalziumdynamik, also die Veränderung und Regulation der zellulären Kalziumkonzentration, eine wichtige Rolle. Auf die eine oder andere Weise ist Kalzium folglich an der neuronalen Signalverarbeitung und -weiterleitung wesentlich beteiligt. Daher bietet es sich an, die Kalziumdynamik als Indikator für Nervenzellaktivität zu messen.
Um Informationen über unsere Umwelt zu verarbeiten, kodiert, kombiniert und interpretiert das Gehirn eine Vielzahl von Signalen mittels komplizierter, elektrischer Aktivitätsmuster, die über das Gehirn verteilt sind. Simultane Messungen der Aktivität an verschiedenen Orten im Gehirn (z.B. mit Hilfe von Elektroden) verschaffen uns wichtige Einblicke und tragen dazu bei, dieses neuronale Netzwerk zu verstehen. Doch elektrische Ableitungen sind weder dazu geeignet, die Aktivität in den feinen Fortsätzen einzelner Nervenzellen aufzulösen, noch biochemische (nicht-elektrische) Signale zu messen. Daher wenden sich heute viele Forscher optischen Verfahren zu, bei denen Änderungen in der Kalziumkonzentration als Maß für neuronale Aktivität aufgezeichnet werden können („Calcium imaging“).
Mazahir Hasan und seine Kollegen am Max-Planck-Institut für medizinische Forschung haben transgene Mäuse geschaffen, in deren Gehirn fluoreszierenden Kalzium-Indikatorproteine exprimiert werden. Da die Gensequenz für diesen Indikator in das Genom der Mäuse integriert wurde, eröffnet sich die Möglichkeit, die Indikatoren mit Hilfe zelltypspezifischer Promotoren gezielt in bestimmten Arten von Neuronen zu exprimieren. Dies erlaubt den Forschern, die Aktivität einer bestimmten Population von Nervenzellen zu kartieren.
Um im lebenden Gewebe untersuchen zu können, wo das von einem bestimmten Gen kodierte Protein exprimiert wird, fügt man dem zu untersuchenden Gen die Sequenz für ein fluoreszierendes Protein hinzu. Fluoreszierende Kalzium-Indikatorproteine („fluorescent calcium indicator protein“ oder FCIPs) ändern ihre Fluoreszenz dann, wenn sie Kalzium binden. In den späten 1990er Jahren entwickelt, wurden FCIPs bisher erfolgreich in Würmern, Fruchtfliegen und Zebrafischen eingesetzt. Doch bis vor kurzem war es nicht möglich, FCIPs auch im Gehirn von Säugetieren stabil und funktionell zu exprimieren.
Die Heidelberger Forscher benutzen einen regulatorischen Promotor namens ‚Ptet’ („TET system“), um die FCIPs in das Gehirn der Mäuse einzuschleusen. ’Ptet’ erlaubt die Expression des Kalziumindikators in verschiedenen Nervenzellpopulationen. Die Forscher analysierten Mauslinien mit hoher FCIP-Expression, um die Funktionalität des Indikators zu testen. Die Expression war stark genug, um die FCIPs in den Zellen mit einem Fluoreszenzmikroskop lokalisieren zu können.
Die entscheidende Frage war jedoch, ob die FCIPs auch im lebenden Mäusehirngewebe Kalziumsignale anzuzeigen vermögen. Dazu stimulierten die Forscher Gehirnschnitte von Mäusen mit mittlerer bis hoher FCIP-Expression mit Reizen, von denen bekannt ist, dass sie zu einer Erhöhung der intrazellulären Kalziumkonzentration führen. Sie beobachteten, dass die FCIP-Fluoreszenz wie erwartet als Folge des Reizes schnell anstiegt. Auch in vivo konnten zum Beispiel durch Geruchsstimulation erhebliche Fluoreszenzänderungen ausgelöst werden. Die Tatsache, dass „schnelle und robuste“ FCIP-Signale in lebenden Tieren (in vivo) bei sensorischer Stimulation gemessen werden konnten, zeigt, so die Wissenschaftler, dass FCIPs als Reporter die Aktivität neuronaler Populationen in lebenden Systemen anzeigen. Da die Indikatorproteine stabil exprimiert werden – auch 8-12 Wochen alte Mäuse zeigten FCIP-Expression -, eignen sie sich auch dann, wenn neuronale Aktivität über ausgedehnte Zeiträume beobachtet werden soll.
Noch müssen einige Fragen geklärt werden, so zum Beispiel, warum sich bisher nur mit dem Ptet-Promotor eine hohe FCIP-Expression im Gehirn erreichen lässt, oder warum nicht alle Neurone einer bestimmten Population das Protein exprimieren. Nichtsdestotrotz haben die Max-Planck-Forscher erfolgreich gezeigt, dass mit dem TET-System (mit dem ’Ptet’-promoter) eine stabile und funktionelle Expression von Kalziumindikatoren möglich ist. Mit dieser Methode werden Komplikationen invasiver Techniken, wie das Einbringen von Indikatorfarbstoffen durch einen chirurgischen Eingriff, vermieden. Außerdem sind die gemessenen Signale leichter zu interpretieren, da die FCIP-exprimierenden Zellpopulationen bereits vorher bekannt sind. Die Methode eignet sich für lebende Tiere (in vivo); hier können FCIPs anzeigen, wo und wann Neurone aktiv sind. Und nicht zuletzt: FCIP-Mäuse können mit Mäusen gekreuzt werden, die Mutationen in für die Nervenzellaktivität wichtigen Genen tragen, und so klären helfen, welche Rolle diese Gene in neuronalen Netzwerk spielen.
Weitere Informationen erhalten Sie von:
Dr. Mazahir T. Hasan
Max-Planck-Institut für medizinische Forschung, Heidelberg
Tel.: 06221 486-314
Fax: 06221 486-325
E-Mail: mhasan@mpimf-heidelberg.mpg.de
Prof. Winfried Denk
Max-Planck-Institut für medizinische Forschung, Heidelberg
Tel.: 06221 486-335
Fax: 06221 486-325
E-Mail: denk@mpimf-heidelberg.mpg.de
Media Contact
Weitere Informationen:
http://www.mpimf-heidelberg.mpg.deAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Das Mikrobiom verändert sich dynamisch und begünstigt wichtige Funktionen für den Wirt
Ein interdisziplinäres Forschungsteam des Kieler SFB 1182 untersucht am Beispiel von Fadenwürmern, welche Prozesse die Zusammensetzung des Mikrobioms in Wirtslebewesen steuern. Alle vielzelligen Lebewesen – von den einfachsten tierischen und…

Wasser im Boden – genaue Daten für Landwirtschaft und Klimaforschung
Die PTB präsentiert auf der Woche der Umwelt, wie sich die Bodenfeuchte mithilfe von Neutronenstrahlung messen lässt. Die Bodenfeuchte hat nicht nur Auswirkungen auf die Landwirtschaft, sondern ist als Teil…

Bioreaktor- und Kryotechnologien für bessere Wirkstofftests mit humanen Zellkulturen
Medizinische Wirkstoffforschung… Viele Neuentwicklungen von medizinischen Wirkstoffen scheitern, weil trotz erfolgreicher Labortests mit Zellkulturen starke Nebenwirkungen bei Probanden auftreten. Dies kann passieren, wenn zum Beispiel die verwendeten Zellen aus tierischem…





















