Neue Details der Reizübertragung in Lebewesen aufgedeckt
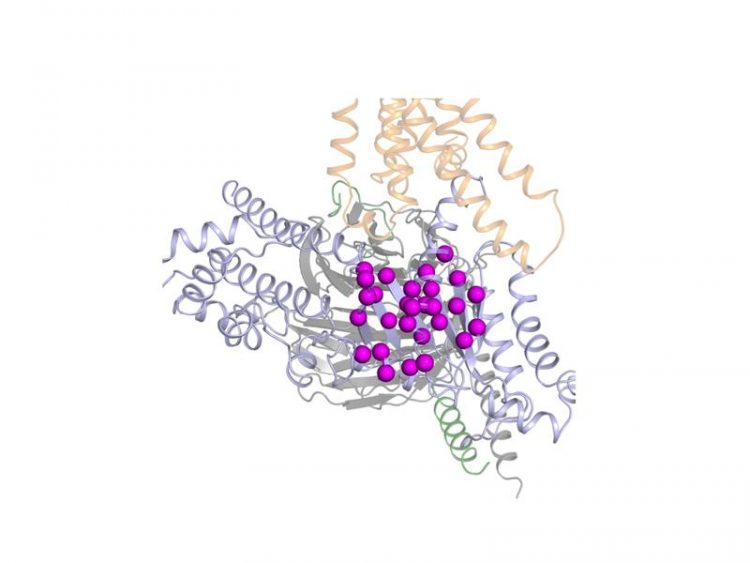
Vereinfachte Darstellung der Struktur des untersuchten G-Proteins (in Grau) und des daran gekoppelten Rezeptors. Die Kugeln stellen die massgeblichen Aminosäuren dar. Dawei Sun
Wenn wir einen Gegenstand sehen, passiert im Grunde Folgendes: Das vom Gegenstand ausgehende Licht trifft unser Auge, woraufhin Nervenzellen ein Signal ins Gehirn weiterleiten, das vom Gehirn als ein Bild des Gegenstandes interpretiert wird. Den Anstoss für die Signalübertragung gibt das Protein Rhodopsin, das ein sogenannter G-Protein-gekoppelter Rezeptor ist.
Dieses Protein in den Zellen der Netzhaut wird aktiviert, sobald Licht das Auge erreicht. Rhodopsin fungiert wie ein Schalter, der, einmal umgelegt, das Signal an sogenannte G-Proteine im Innern der Zelle überträgt. Diese verstärken das Signal und geben es in der Zelle weiter. Auf ähnliche Weise funktionieren viele Paare von G-Protein-gekoppeltem Rezeptor (auf Englisch G-protein coupled receptor, kurz GPCR) und G-Protein.
So wird etwa der Adrenalinrezeptor in den Muskelzellen aktiviert, wenn der Körper in einer Stresssituation das Hormon Adrenalin ausschüttet. Das dazugehörige G-Protein leitet hier das Signal weiter, das mit der Anspannung der Muskeln endet. Nun legt ein Team unter der Leitung von Forschenden des Paul Scherrer Instituts PSI und der ETH Zürich mit Beteiligung des britischen MRC Laboratory of Molecular Biology und des Pharmaunternehmens Roche neue Details darüber vor, wie die Aktivierung dieser Proteine vonstattengeht. Die Erkenntnisse sind übertragbar auf andere Vorgänge wie das Riechen, das Schmecken und viele weitere, bei denen ähnliche Proteine an der Signalübertragung beteiligt sind. Sie könnten zudem dazu dienen, eine Fülle neuer, besserer Medikamente zu entwickeln.
Nobelpreiswürdige Forschung
Dank jahrzehntelanger Forschung hat die Fachwelt bisher zwar viel über das Zusammenspiel von G-Proteinen und den dazugehörigen GPCR gelernt. So wurden Nobelpreise in den Jahren 1994 und 2012 für die Entdeckung dieser Rezeptoren bzw. für die Aufklärung ihres Kopplungsmechanismus mit den G-Proteinen verliehen. Wie das G-Protein im Detail aktiviert wird, war bisher aber nicht bekannt. Die neue Studie schliesst diese Lücke. Sie zeigt, wie sich die Form von G-Proteinen während ihrer Aktivierung verändert und welche Protein-Bausteine hinter diesen Veränderungen stecken.
Nur wenige Bausteine geben den Ton an
Wie jedes Protein, sind G-Proteine aus Bausteinen zusammengesetzt, die die Fachleute als Aminosäuren bezeichnen. Diese Aminosäuren sind in einem Protein gemäss einem genauen Bauplan in einer bestimmten Reihenfolge miteinander verknüpft. Beim jetzt untersuchten G-Protein sind es genau 354 Aminosäuren. Um herauszufinden, wie dieses G-Protein aktiviert wird, haben die Autoren der Studie jede einzelne dieser 354 Aminosäuren nach einander gegen eine andere Aminosäure ausgetauscht. Dann haben sie gemessen, wie sich der Austausch auf die Stärke der Aktivierung auswirkt.
„Die Analyse der Messungen zeigt, dass nur eine kleine Gruppe von rund 20 Aminosäuren massgeblich an der Aktivierung des G-Proteins beteiligt ist“, erklärt Dawei Sun, der die Experimente als Teil seiner Dissertation am PSI durchführte. Tatsächlich hat nur der Austausch dieser Aminosäuren einen entscheidenden Einfluss auf die Aktivierung des G-Proteins ausgeübt, während der Austausch der restlichen Aminosäuren für die Aktivierung des Proteins praktisch folgenlos blieb.
Den Einfluss der massgeblichen Aminosäuren konnten die Forschenden an Veränderungen in der Form eines Abschnitts des G-Proteins feststellen, der im deaktivierten Zustand einer ausgerollten Luftschlange (Helix-Struktur) ähnelt. „Beim Austausch der entscheidenden Aminosäuren fehlten an dieser Struktur die üblichen Windungen“, erläutert Dmitry Veprintsev, der Forschungsleiter der Studie im Labor für Biomolekulare Forschung am PSI. „Wir konnten damit beweisen, dass während der Aktivierung des G-Proteins die Luftschlangenstruktur zumindest vorübergehend verschwindet“, fügt Veprintsev hinzu.
Nützlich für fast jedes dritte Medikament
Die Bedeutung der Arbeit beschränkt sich nicht auf ein einzelnes Protein. Der neu entdeckte Mechanismus ist vielmehr universell. Das heisst, er ist nicht nur bei dem einen, in dieser Studie untersuchten G-Protein, sondern bei allen G-Proteinen am Werk. Das belegen umfangreiche Computerberechnungen eines Teams um Madan Babu vom MRC Laboratory of Molecular Biology, die kürzlich in der Zeitschrift Nature veröffentlicht wurden.
Veprintsev betont, dass mit der vorliegenden Arbeit die massgeblichen Aminosäuren identifiziert wurden, die dem Aktivierungsmechanismus eines G-Proteins zugrunde liegen. Gebhard Schertler, Leiter des Forschungsbereichs Biologie und Chemie am PSI legt dar, dass dieses Wissen die Entwicklung von Medikamenten, die durch die Aktivierung eines GPCR-Rezeptors und des dazugehörigen G-Proteins wirken, einen entscheidenden Schritt vorantreibt.
Der potenzielle Nutzen ist nicht zu unterschätzen: Schon heute entfalten rund 30 Prozent aller erhältlichen Medikamente ihre Wirkung auf diese Weise. Zudem könnten die Folgen über die G-Proteine hinausreichen. „Unsere Methode kann in Zukunft auch bei anderen wichtigen Proteinen angewandt werden, um deren Wirkmechanismus zu verstehen“, versichert Veprintsev.
Text: Paul Scherrer Institut/Leonid Leiva
Über das PSI
Das Paul Scherrer Institut PSI entwickelt, baut und betreibt grosse und komplexe Forschungsanlagen und stellt sie der nationalen und internationalen Forschungsgemeinde zur Verfügung. Eigene Forschungsschwerpunkte sind Materie und Material, Energie und Umwelt sowie Mensch und Gesundheit. Die Ausbildung von jungen Menschen ist ein zentrales Anliegen des PSI. Deshalb sind etwa ein Viertel unserer Mitarbeitenden Postdoktorierende, Doktorierende oder Lernende. Insgesamt beschäftigt das PSI 1900 Mitarbeitende, das damit das grösste Forschungsinstitut der Schweiz ist. Das Jahresbudget beträgt rund CHF 350 Mio.
Kontakt/Ansprechpersonen:
Dr. Dmitry Veprintsev
Projektleiter
Labor für Biomolekulare Forschung
Paul Scherrer Institut,
Telefon: +41 (0)56 310 5246
E-Mail: dmitry.veprintsev@psi.ch
Dr. Gregor Cicchetti
Scientific Relations Manager
Forschungsbereich Biologie und Chemie
Paul Scherrer Institut
Telefon: +41 (0)56 310 5382
E-Mail: gregor.cicchetti@psi.ch
Originalveröffentlichung:
Probing Gαi1 protein activation at single–amino acid resolution
Dawei Sun, Tilman Flock, Xavier Deupi, Shoji Maeda, Milos Matkovic, Sandro Mendieta, Daniel Mayer, Roger Dawson, Gebhard F.X. Schertler, M. Madan Babu, Dmitry Veprintsev
Nature Structural & Molecular Biology, 10 August 2015
http://nature.com/articles/doi:10.1038/nsmb.3070
http://www.psi.ch/lbr Labor für Biomolekulare Forschung am PSI
http://psi.ch/Qz48 Text der Pressemitteilung mit Bildern
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Diamantstaub leuchtet hell in Magnetresonanztomographie
Mögliche Alternative zum weit verbreiteten Kontrastmittel Gadolinium. Eine unerwartete Entdeckung machte eine Wissenschaftlerin des Max-Planck-Instituts für Intelligente Systeme in Stuttgart: Nanometerkleine Diamantpartikel, die eigentlich für einen ganz anderen Zweck bestimmt…

Neue Spule für 7-Tesla MRT | Kopf und Hals gleichzeitig darstellen
Die Magnetresonanztomographie (MRT) ermöglicht detaillierte Einblicke in den Körper. Vor allem die Ultrahochfeld-Bildgebung mit Magnetfeldstärken von 7 Tesla und höher macht feinste anatomische Strukturen und funktionelle Prozesse sichtbar. Doch alleine…

Hybrid-Energiespeichersystem für moderne Energienetze
Projekt HyFlow: Leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem für moderne Energienetze. In drei Jahren Forschungsarbeit hat das Konsortium des EU-Projekts HyFlow ein extrem leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem entwickelt, das einen…





















