Molekulare Sortiermaschinen bringen Membranproteine an die Zielmembran
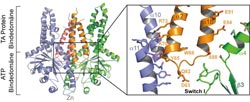
Kristallstruktur des Get1-Rezeptors (orange und rot) im Komplex mit dem Get3-Dimer (blau und grün). Die Vergrößerung zeigt, dass sich Get1 wie ein Keil zwischen die beiden Get3 Moleküle schiebt und die Schließung des Dimers blockiert.<br>Abbildung: Biochemie-Zentrum der Universität Heidelberg<br>
Der zielgerichtete Transport von zellulären Proteinen in oder durch eine Membran ist für alle Zellen lebensnotwendig, da viele Proteine während oder nach ihrer Synthese an einen anderen Bestimmungsort gebracht werden müssen. Die Proteinsortierung stellt daher besonders für eukaryontische Zellen mit ihrer Vielzahl an membranumschlossenen Organellen eine logistische Herausforderung dar. Komplexe Sortier- und Transportmaschinen sorgen dafür, dass Proteine an den richtigen Bestimmungsort in der Zelle gelangen.
Beim Sortierungsprozess helfen Signalsequenzen, die wie eine Art „Postleitzahl“ von spezifischen Maschinen erkannt werden. Einen bislang unbekannten Teil der Mechanismen konnten Wissenschaftler der Universität Heidelberg zusammen mit Forschern aus Frankfurt und Harvard (USA) entschlüsseln. In der neuen Studie wurde die Sortierung und Insertion von Membranproteinen untersucht, deren Signalsequenz am Ende des Proteins liegt. Diese sogenannten „tail anchored“ (TA) Membranproteine sind an entscheidenden zellulären Prozessen beteiligt, wie zum Beispiel der Membranfusion oder dem Zelltod. Die Forschungsergebnisse wurden in „Science“ veröffentlicht.
„Die Komponenten für die Insertion der TA-Membranproteine konnten vor kurzem identifiziert werden. Weitgehend unbekannt war jedoch, wie die Maschinen für die Erkennung und den Transport dieser Proteine arbeiten“, sagt Prof. Dr. Irmgard Sinning vom Biochemie-Zentrum der Universität Heidelberg. Den zugrundeliegenden molekularen Mechanismus konnte die Arbeitsgruppe von Prof. Sinning jetzt in enger Zusammenarbeit mit Prof. Dr. Volker Dötsch von der Goethe-Universität Frankfurt und Prof. Dr. Vlad Denic von der Universität Harvard entschlüsseln. Im Mittelpunkt der interdisziplinären Untersuchungen steht der sogenannte Get-Weg. Dabei steht „Get“ für „guided entry of tail-anchored membrane proteins“ – einen speziellen Transportweg für die Familie der TA-Membranproteine zum endoplasmatischen Retikulum (ER).
Die zentrale Komponente des Get-Weges ist das Get3-Protein, eine dimere ATPase, die die Energie der ATP-Spaltung für die Insertion der TA-Membranproteine nutzt. Um den Insertionsprozess am ER entschlüsseln zu können, haben die Wissenschaftler in ihrer Studie strukturbiologische Untersuchungsmethoden – die Proteinkristallographie und die NMR-Spektroskopie – mit biochemischen und zellbiologischen Ansätzen verknüpft. Erstmals konnten die Wissenschaftler die Funktion von zwei Rezeptorproteinen – Get1 und Get2 – klären. Hochaufgelöste Kristallstrukturen von verschiedenen Reaktionsintermediaten zeigen, dass der Get3-Dimer an diese Rezeptoren bindet und sich dabei schrittweise öffnet. Dadurch wird eine kontrollierte Insertion des TA-Proteins ermöglicht. Ein erstes Modell der rezeptor-unterstützten Membraninsertion konnte erstellt werden, das jetzt die Grundlage für weitere Studien bildet.
Die Untersuchungen wurden durch den Sonderforschungsbereich „Dynamik makromolekularer Komplexe im biosynthetischen Transport“ (SFB 638) der Universität Heidelberg gefördert. Wichtig für die Forschungsarbeiten war dabei die Proteinkristallisationsplattform, die vor kurzem am Biochemie-Zentrum mit Unterstützung durch den Exzellenzcluster „CellNetworks“ der Ruperto Carola eingerichtet werden konnte.
Originalveröffentlichung:
Stefer, S., Reitz, S., Wang, F., Wild, K., Pang, Y.-Y., Schwarz, D., Bomke, J., Hein, C., Löhr, F., Bernhard, F., Denic, V., Dötsch, V. & Sinning, I.: Structural Basis for Tail-Anchored Membrane Protein Biogenesis by the Get3-Receptor Complex, Science Online, 30 June 2011, DOI: 10.1126/science.1207125.
Kontakt:
Prof. Dr. Irmgard Sinning
Biochemie-Zentrum, Telefon (06221) 54-4781
irmi.sinning@bzh.uni-heidelberg.de
Kommunikation und Marketing
Pressestelle, Telefon (06221) 54-2311
presse@rektorat.uni-heidelberg.de
Media Contact
Weitere Informationen:
http://www.bzh.uni-heidelberg.deAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Neue universelle lichtbasierte Technik zur Kontrolle der Talpolarisation
Ein internationales Forscherteam berichtet in Nature über eine neue Methode, mit der zum ersten Mal die Talpolarisation in zentrosymmetrischen Bulk-Materialien auf eine nicht materialspezifische Weise erreicht wird. Diese „universelle Technik“…

Tumorzellen hebeln das Immunsystem früh aus
Neu entdeckter Mechanismus könnte Krebs-Immuntherapien deutlich verbessern. Tumore verhindern aktiv, dass sich Immunantworten durch sogenannte zytotoxische T-Zellen bilden, die den Krebs bekämpfen könnten. Wie das genau geschieht, beschreiben jetzt erstmals…

Immunzellen in den Startlöchern: „Allzeit bereit“ ist harte Arbeit
Wenn Krankheitserreger in den Körper eindringen, muss das Immunsystem sofort reagieren und eine Infektion verhindern oder eindämmen. Doch wie halten sich unsere Abwehrzellen bereit, wenn kein Angreifer in Sicht ist?…





















