Kommunikation in der Zelle: wichtiger Teilschritt der Signalübermittlung aufgeklärt
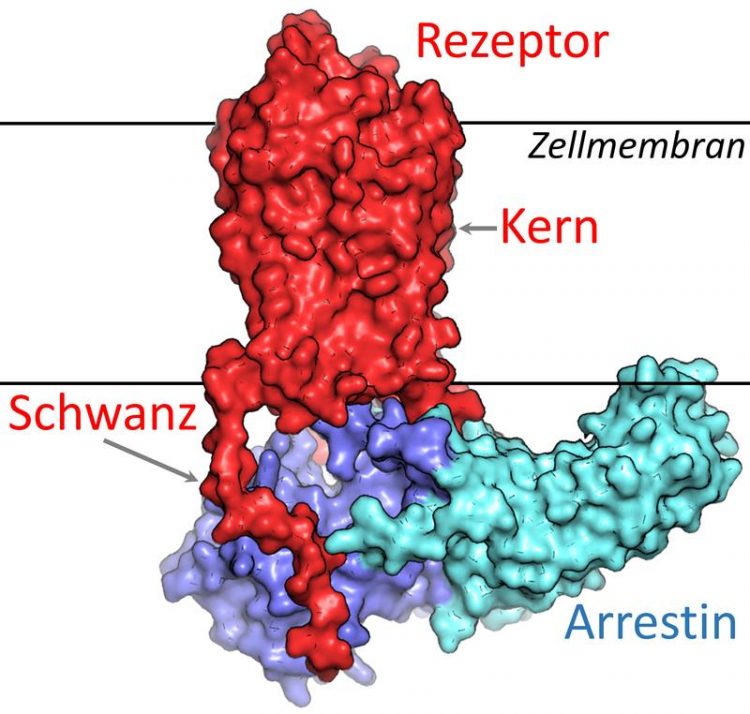
Molekülstruktur von Arrestin (lila und türkis), gebunden an einen GPCR (rot) in der Zellmembran (horizontale schwarze Linien). Die veröffentlichte Studie untersuchte, wie der „Kern“ und der „Schwanz“ des Rezeptors Veränderungen in der molekularen Struktur von Arrestin auslösen und damit die Bindung von Arrestin an den Rezeptor stimulieren. Copyright: Naomi Latorraca und Ron Dror/Stanford University
Signale werden innerhalb des Körpers oft mit Hilfe von Botenstoffen übermittelt. Diese Moleküle binden an spezifische Andockstellen auf der Oberfläche der Zielzelle und lösen eine Reihe von Folgereaktionen im Inneren der Zelle aus. Die größte Familie von Andockstellen sind die sogenannten G-Protein-gekoppelten Rezeptoren (GPCR).
Diese GPCRs sind nicht nur an der Verarbeitung von Sinnesreizen beteiligt, sie sind auch ein wichtiges Ziel für die medikamentöse Behandlung von Krankheiten wie Asthma, Schizophrenie, Bluthochdruck und Krebs. 30 bis 40 Prozent aller derzeit verschriebenen Medikamente gegen diese Erkrankungen zielen auf die GPCRs ab.
Die Funktionsweise der GPCRs in der Zelle hängt davon ab, wie die Rezeptoren mit verschiedenen Proteinen in der Zelle wechselwirken. Eines dieser Proteine ist das Arrestin. Es steuert, welche Signalwege durch verschiedene Rezeptoren und ihre verschiedenen Bindungspartner aktiviert werden.
Das Ziel der Studie war es, den molekularen Mechanismus der Aktivierung des GPCR-Arrestin-Komplexes aufzuklären. Hierzu wurde mit Hilfe von Computersimulationen und Fluoreszenzspektroskopie die Veränderungen in der molekularen Struktur des an den Rezeptor gebundenen Arrestins überwacht.
Die Ergebnisse erlauben erstmals einen detaillierten Einblick in die molekularen Interaktionen von GPCR und Arrestin während der Signalweitergabe in der Zelle. Dr. Martha Sommer vom Institut für Medizinische Physik und Biophysik der Charité über die Bedeutung ihrer Forschung für die Grundlagenmedizin:
„Je besser wir verstehen, wie diese Rezeptoren mit den Bindungspartnern im Inneren der Zelle interagieren, desto besser sind wir in der Lage, Medikamente zu entwickeln, die eine gewünschte therapeutische Wirkung haben, aber unerwünschte und schädliche Nebenwirkungen vermeiden.“
Nachfolgende Studien sollen den Blick auf die Vorgänge zwischen GPCR und Arrestin weiter schärfen, um die Entwicklung von Arzneimitteln zu ermöglichen, die spezifisch auf diesen Signalweg einwirken.
Publikation:
* Latorraca NR, et al. Molecular mechanism of GPCR-mediated arrestin activation. Nature. 2018 May 2. DOI: 10.1038/s41586-018-0077-3.
Kooperation und Förderung:
Die Studie ist eine Kooperation zwischen der Charité und Prof. Dr. Ron Dror von der Stanford University in Kalifornien, USA. Die AG Arrestin der Charité wird von der Deutschen Forschungsgemeinschaft gefördert, im Rahmen des Sonderforschungsbereichs 740 „Von Molekülen zu Modulen: Organisation und Dynamik zellulärer Funktionseinheiten“.
Bildunterschrift:
Molekülstruktur von Arrestin (lila und türkis), gebunden an einen GPCR (rot) in der Zellmembran (horizontale schwarze Linien). Die veröffentlichte Studie untersuchte, wie der „Kern“ und der „Schwanz“ des Rezeptors Veränderungen in der molekularen Struktur von Arrestin auslösen und damit die Bindung von Arrestin an den Rezeptor stimulieren. Copyright: Naomi Latorraca und Ron Dror/Stanford University.
Kontakt:
Dr. Martha Sommer
Institut für Medizinische Physik und Biophysik
Charité – Universitätsmedizin Berlin
t: +49 30 450 524 200
E-Mail: martha.sommer@charite.de
Links:
– Institut für Medizinische Physik und Biophysik
https://biophysik.charite.de/
– AG Arrestin am Institut für Medizinische Physik und Biophysik
https://biophysik.charite.de/forschung/ag_arrestin/
– Originaltext der Publikation:
https://www.nature.com/articles/s41586-018-0077-3
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Neue universelle lichtbasierte Technik zur Kontrolle der Talpolarisation
Ein internationales Forscherteam berichtet in Nature über eine neue Methode, mit der zum ersten Mal die Talpolarisation in zentrosymmetrischen Bulk-Materialien auf eine nicht materialspezifische Weise erreicht wird. Diese „universelle Technik“…

Tumorzellen hebeln das Immunsystem früh aus
Neu entdeckter Mechanismus könnte Krebs-Immuntherapien deutlich verbessern. Tumore verhindern aktiv, dass sich Immunantworten durch sogenannte zytotoxische T-Zellen bilden, die den Krebs bekämpfen könnten. Wie das genau geschieht, beschreiben jetzt erstmals…

Immunzellen in den Startlöchern: „Allzeit bereit“ ist harte Arbeit
Wenn Krankheitserreger in den Körper eindringen, muss das Immunsystem sofort reagieren und eine Infektion verhindern oder eindämmen. Doch wie halten sich unsere Abwehrzellen bereit, wenn kein Angreifer in Sicht ist?…





















