Immunzellen blockieren, um Bauchspeicheldrüsenkrebs zu hemmen
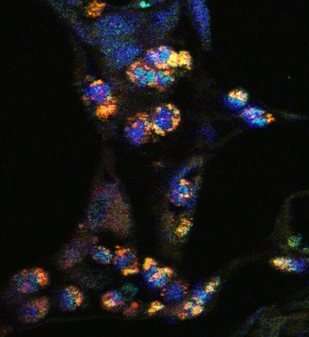
Immunzellen (T-Zellen) im Bauchspeicheldrüsenkrebs, die ihre Entzündungsstoffe (Zytokine) über den alternativen p38-Signalweg bilden und dadurch das Tumorwachstum fördern. Pathologisches Institut, Universitätsklinikum Heidelberg
Sammeln sich Immunzellen um einen Tumor, um ihn zu bekämpfen, kann das manchmal dem Tumor sogar eher nützen als schaden. Wie es dazu kommt, haben Wissenschaftler des Pathologischen Instituts am Universitätsklinikum Heidelberg und des National Cancer Institutes in Bethesda, Maryland, USA, im international renommierten Journal „Nature Medicine“ beschrieben.
Sie zeigten am Beispiel des äußerst aggressiven Bauchspeicheldrüsenkrebs, dass der weitere Verlauf der Erkrankung – sowohl im Tierversuch als auch bei Patienten – entscheidend davon abhängt, wie häufig in den versammelten Immunzellen ein bestimmter Signalweg aktiviert wird, mit dem diese die Produktion von Entzündungs-Botenstoffen in Gang setzen.
Bilden viele sogenannte T-Zellen ihre Entzündungsstoffe über diesen Mechanismus, den sogenannten alternativen p38-Signalweg, regen sie damit das Tumorwachstum an. Blockierten die Forscher diesen Signalweg, der nur in diesen Immunzellen vorkommt, wuchs der Krebs deutlich langsamer. Die Arbeit ist vorab online in der renommierten Fachzeitschrift Nature Medicine erschienen.
„Das eröffnet neue Behandlungsmöglichkeiten: Durch die Blockade dieses Signalwegs könnte man etablierte Therapien durch die Wachstumshemmung entscheidend unterstützen und so Zeit für die Patienten gewinnen“, sagt Dr. Matthias Gaida, einer der Erstautoren und Pathologe in Heidelberg.
Botenstoffe bei chronischen Entzündungsreaktionen fördern Tumorwachstum
In von Bauchspeicheldrüsenkrebs (Pankreaskarzinom) befallenem Gewebe findet sich in der Regel eine dichte Anhäufung von Immunzellen. Diese schütten Botenstoffe, die sogenannten Zytokine, aus, locken damit weitere Immunzellen an und halten eine chronische Entzündungsreaktion am Laufen.
Zytokine sind zwar wichtig, um den Angriff des Immunsystems auf den Tumor zu koordinieren, einige von ihnen fördern aber auch die Vermehrung, Wanderung und Ausreifung von Zellen – eben auch der Tumorzellen. Da sie dank der Abwehrreaktion des Immunsystems rund um den Tumor in hoher Konzentration vorkommen, erhalten die Krebszellen einen regelrechten Wachstumsschub.
Diese tumorfördernde Wirkung haben aber vor allem Zytokine, die von T-Zellen über einen speziellen Stoffwechselweg hergestellt werden, wie die Forscher um Dr. Matthias Gaida und seinen US-amerikanischen Kollegen Dr. Muhammad S. Alam herausfanden.
Diesen Immunzellen stehen zwei Wege zur Bildung von Zytokinen zur Verfügung. Kritisch ist der sogenannte „alternative p38-Signalweg“, benannt nach dem Protein p38, das die zentrale Rolle in dieser Reaktionskette spielt. Die Untersuchung von Gewebeproben von 192 Patienten mit Pankreaskarzinom ergab, dass die Menge der T-Zellen mit aktiviertem alternativem p38-Signalweg in der Umgebung des Tumors den weiteren Verlauf der Erkrankung beeinflusst.
Patienten, bei denen nur ein Zehntel der T-Zellen oder weniger diesen Signalweg aktivierten, überlebten länger, im Durchschnitt rund 20 Monate, der Krebs breitete sich langsamer aus. Bei einem höheren Anteil wirkten die Zytokine der T-Zellen tumorfördernd und die Überlebenszeit der Patienten lag im Mittel bei knapp zehn Monaten. Versuche mit verschiedenen Mauslinien bestätigten dieses Ergebnis.
Behandlung des Immunsystems verhindert Resistenzen beim Tumor
Blockierten die Wissenschaftler im Tierversuch gezielt den alternativen Signalweg mit einem eigens entwickelten Hemmstoff, wurde die entzündungs- und tumorfördernde Zytokinbildung unterdrückt: Der Übergang von Krebsvorstufen zum Pankreaskarzinom dauerte länger, bestehende Tumoren wuchsen langsamer und die Neubildung kleiner Blutgefäße zur Versorgung des Tumorgewebes verzögerte sich.
Bei dem Hemmstoff handelt es sich um ein Eiweißfragment, das intravenös verabreicht wurde und keine Nebenwirkungen auslöste. „Der Vorteil dieses Therapieansatzes ist, dass er sich nicht gegen die Tumorzellen selbst richtet, die ihre Eigenschaften ständig verändern und so schnell resistent gegen die Behandlung werden, sondern ausschließlich gegen die stabile Zellpopulation der T-Zellen“, so Gaida.
Literatur:
Alam MS*, Gaida MM*, Bergmann F, Lasitschka F, Giese T, Giese NA, Hackert T, Hinz U, Hussain SP, Kozlov SV, Ashwell JD. Selective inhibition of the p38 alternative activation pathway in infiltrating T cells inhibits pancreatic cancer progression. Nat Med. 2015 Nov;21(11):1337-43. doi: 10.1038/nm.3957. Epub 2015, Oct 19. PubMed PMID: 26479921.
*these authors contributed equally
Abstract: http://www.nature.com/nm/journal/vaop/ncurrent/full/nm.3957.html
Kontakt:
Dr. med. Matthias Gaida
Abteilung für Allgemeine Pathologie
Pathologisches Institut des Universitätsklinikums Heidelberg
Tel.: 06221 56-34795
E-Mail: Matthias.Gaida@med.uni-heidelberg.de
Dr. Katrin Woll
Koordinatorin
Pathologisches Institut des Universitätsklinikums Heidelberg
Tel.: 06221 56-39186
E-Mail: katrin.woll@med.uni-heidelberg.de
Universitätsklinikum und Medizinische Fakultät Heidelberg
Krankenversorgung, Forschung und Lehre von internationalem Rang
Das Universitätsklinikum Heidelberg ist eines der bedeutendsten medizinischen Zentren in Deutschland; die Medizinische Fakultät der Universität Heidelberg zählt zu den international renommierten biomedizinischen Forschungseinrichtungen in Europa. Gemeinsames Ziel ist die Entwicklung innovativer Diagnostik und Therapien sowie ihre rasche Umsetzung für den Patienten. Klinikum und Fakultät beschäftigen rund 12.600 Mitarbeiterinnen und Mitarbeiter und engagieren sich in Ausbildung und Qualifizierung. In mehr als 50 klinischen Fachabteilungen mit ca. 1.900 Betten werden jährlich rund 66.000 Patienten voll- bzw. teilstationär und mehr als 1.000.000 mal Patienten ambulant behandelt. Das Heidelberger Curriculum Medicinale (HeiCuMed) steht an der Spitze der medizinischen Ausbildungsgänge in Deutschland. Derzeit studieren ca. 3.500 angehende Ärztinnen und Ärzte in Heidelberg. www.klinikum.uni-heidelberg.de
http://home.ccr.cancer.gov/inthejournals/itj_alam.asp Pressemitteilung des National Cancer Institute
http://www.klinikum.uni-heidelberg.de/Pathologisches-Institut.112.0.html Pathologisches Institut
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Diamantstaub leuchtet hell in Magnetresonanztomographie
Mögliche Alternative zum weit verbreiteten Kontrastmittel Gadolinium. Eine unerwartete Entdeckung machte eine Wissenschaftlerin des Max-Planck-Instituts für Intelligente Systeme in Stuttgart: Nanometerkleine Diamantpartikel, die eigentlich für einen ganz anderen Zweck bestimmt…

Neue Spule für 7-Tesla MRT | Kopf und Hals gleichzeitig darstellen
Die Magnetresonanztomographie (MRT) ermöglicht detaillierte Einblicke in den Körper. Vor allem die Ultrahochfeld-Bildgebung mit Magnetfeldstärken von 7 Tesla und höher macht feinste anatomische Strukturen und funktionelle Prozesse sichtbar. Doch alleine…

Hybrid-Energiespeichersystem für moderne Energienetze
Projekt HyFlow: Leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem für moderne Energienetze. In drei Jahren Forschungsarbeit hat das Konsortium des EU-Projekts HyFlow ein extrem leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem entwickelt, das einen…





















