Wie Proteine die Außenhülle von Bakterienzellen regulieren
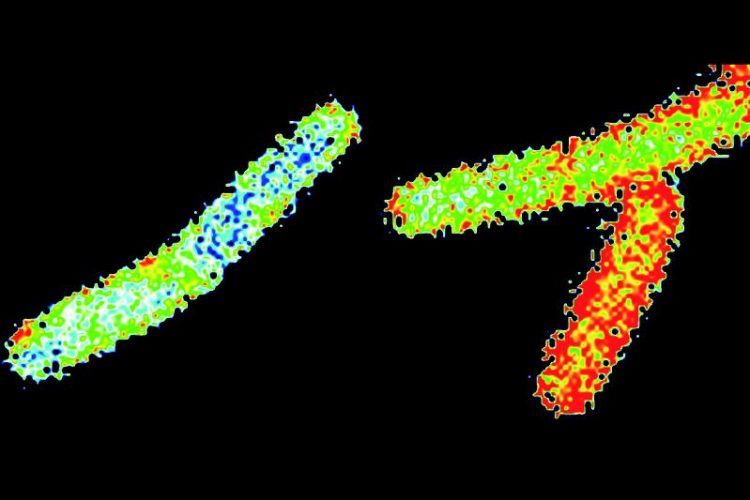
Die Membran von Bacillus subtilis-Zellen wurde mit dem Farbstoff Laurdan markiert. Die Färbung zeigt die Fluidität der Membran an: die Membranen der blaugefärbten Zellen sind deutlich rigider als die Vergleichszellen (in rot). © Prof. Marc Bramkamp
Wie alle Zellen haben Bakterien eine Membran, die sie wie eine Haut nach außen abschirmt. Sie ist nicht statisch, sondern muss einerseits sowohl Substanzen hinein- und herauslassen und andererseits beweglich sein, damit die Bakterienzellen wachsen können.
Um diese Eigenschaften umzusetzen, sind verschiedene Arten von Proteinen in Zellen aktiv, unter anderem die sogenannten Flotilline. Diese Proteine sind von Bakterien bis zum Menschen in Zellen vorhanden.
Bislang nahmen Wissenschaftlerinnen und Wissenschaftler an, dass diese Flotilline vor allem bei der Bildung anderer funktioneller Proteinkomplexe helfen und hochgeordnete Bereiche der Zellmembran eingrenzen.
Ein Team aus internationalen Forschenden unter Beteiligung der Christian-Albrechts-Universität zu Kiel (CAU) fand nun Hinweise auf eine mögliche andere Funktion der Flotilline: Gemeinsam mit Kolleginnen und Kollegen unter anderem von den Universitäten Groningen und Bordeaux konnten die Kieler Forschenden zeigen, dass sie offenbar einen direkten Einfluss auf die Struktur der Zellmembran haben und diese unter bestimmten Bedingungen flüssiger machen können.
Ihre Erkenntnisse veröffentlichten die Wissenschaftlerinnen und Wissenschaftler gestern im renommierten Wissenschaftsjournal eLife.
Flotilline funktionieren möglicherweise anders als bisher angenommen
Alle lebenden Zellen müssen von einer trennenden Barriere umgeben sein, die sie einerseits von ihrer Umgebung abschirmt und die andererseits durchlässig für verschiedene molekulare Substanzen ist. Verschiedene Proteine sind notwendig, um diese Zellmembranen auszubilden und sie mit ihren Funktionen auszustatten.
Bisher nahmen Forschende an, dass die sogenannten Flotillinproteine dazu dienen, zur Bildung der dazu notwendigen funktionellen Proteinkomplexe beizutragen – zum Beispiel indem sie bestimmte Bereiche der Membran abgrenzen. Die nun vorlegte Arbeit aus Professor Marc Bramkamps Arbeitsgruppe Mikrobielle Biochemie und Zellbiologie am Institut für Allgemeine Mikrobiologie der CAU widerspricht nun dieser Auffassung:
„Gemeinsam mit einer Gruppe internationaler Kolleginnen und Kollegen haben wir Hinweise gefunden, dass die Flotillin-Proteine möglicherweise eine ganz andere Funktion übernehmen. Offenbar regulieren sie die Fluidität von Bakterienmembranen, können sie gewissermaßen flüssiger machen und so ihre Eigenschaften verändern“, betont Bramkamp.
Diese Vermutung könnte auch den Effekt erklären, den Flotilline auf den Bau der Zellwand haben: Bausteine für die Zellwand werden im Inneren der Zellen produziert und müssen anschließend nach außen „geschwenkt“ werden, was in einer flüssigeren Membran einfacher gelingt. Zudem fährt die Proteinmaschinerie, die die Zellwand synthetisiert, dynamisch durch die Zellmembran und diese Bewegung ist bei Abwesenheit der Flotilline deutlich reduziert, so dass keine korrekte Zellwand ausgebildet wird.
Ohne Flotilline keine stabile Form
Das Kieler Forschungsteam entwickelte die neue Hypothese unter anderem mit den internationalen Kolleginnen und Kollegen auf Grundlage von Experimenten mit dem stäbchenförmigen Bakterium Bacillus subtilis. Diese zeigten, dass schnell wachsende Zellen in Abwesenheit von Flotillinen ihre typische äußere Form nicht ausbilden können.
Gaben die Forschenden jedoch eine chemische Substanz zur Verflüssigung der Membranen hinzu, behielten die Bakterien ihre Form auch ohne Flotillin-Proteine. „Wir vermuten daher, dass sie einen physikalischen Effekt in den Bakterienzellen übernehmen“, betont Abigail Savietto, Doktorandin in Bramkamps Gruppe an der CAU. „Die Flotilline scheinen also dazu beizutragen, dass die Membran die geeignete physikalische Struktur aufweist, damit Membrangebundene Prozesse richtig funktionieren“, so Savietto weiter.
In weiteren Forschungsarbeiten wollen die Forschenden herausfinden, worin genau der Zusammenhang der Flotillin-Proteine mit der Membran-Fluidität besteht. Ein Ansatz könnte in der Untersuchung der sogenannten Phospholipid-Zusammensetzung liegen.
Diese Lipide sind an der Bildung vieler verschiedener Biomembrane beteiligt. Möglicherweise können die Flotillin-Proteine bestimmte, die Fluidität verringernde Phospholipide binden und so die gesamte Flüssigkeit der Zellmembran erhöhen. Die neue Hypothese des Kieler Forschungsteams birgt damit vielversprechende Perspektiven auch für die Anwendung: So könnte es künftig gelingen, die physikalischen Eigenschaften der bakteriellen Zellmembranen durch die Störung der Flotillin-Funktion gezielt zu beeinflussen.
„Meine Arbeitsgruppe arbeitet seit vielen Jahren an der Funktion der Flotilline und wir wissen, dass Zellen mit veränderter Membranfluidität viel empfindlicher gegenüber herkömmlichen Antibiotika sind. Möglicherweise könnte man den Mechanismus nutzen, um zum Beispiel die Membran von Bakterienzellen gezielt so verändern, dass diese einfacher durch Antibiotika abgetötet werden können“, blickt Bramkamp voraus.
Fotos stehen zum Download bereit:
https://www.uni-kiel.de/de/pressemitteilungen/2020/173-zielinska-elife-laurdan.j…
Bildunterschrift: Prof. Marc Bramkamp und Erstautorin Abigail Savietto erforschten, wie Flotillin-Proteine die Fluidität von Bakterienmembranen regulieren.
© Institut für Allgemeine Mikrobiologie, Uni Kiel
https://www.uni-kiel.de/de/pressemitteilungen/2020/173-zielinska-elife-authors.j…
Bildunterschrift: Phasenkontrastmikroskopische Aufnahme von Bacillus subtilis-Bakterien, bei denen Flotilline mit Hilfe des Grün fluoreszierenden Proteins GFP sichtbar gemacht wurden.
© Prof. Marc Bramkamp
https://www.uni-kiel.de/de/pressemitteilungen/2020/173-zielinska-elife-comp.jpg
Bildunterschrift: Die Membran von Bacillus subtilis-Zellen wurde mit dem Farbstoff Laurdan markiert und mit Hilfe von Fluoreszenzmikroskopie analysiert. Die Färbung zeigt die Fluidität der Membran an: Die Membranen der blaugefärbten Zellen sind deutlich rigider als die sehr fluiden Membranen der Vergleichszellen (in rot).
© Prof. Marc Bramkamp
Weitere Informationen:
Institut für Allgemeine Mikrobiologie, CAU Kiel :
https://www.mikrobio.uni-kiel.de/de/institut-fuer-allgemeine-mikrobiologie
Prof. Marc Bramkamp
Mikrobielle Biochemie und Zellbiologie
Institut für Allgemeine Mikrobiologie, CAU Kiel
Tel.: 0431-880-4341
E-Mail: bramkamp@ifam.uni-kiel.de
Aleksandra Zielińska, Abigail Savietto, Anabela de Sousa Borges, Denis Martinez, Melanie Berbon, Joël R. Roelofsen, Alwin M. Hartman, Rinse de Boer, Ida J. van der Klei, Anna K. H. Hirsch, Birgit Habenstein, Marc Bramkamp, Dirk-Jan Scheffers (2020): Flotillin mediated membrane fluidity controls peptidoglycan synthesis and MreB movement. eLife
First Published: 14 July 2020
https://doi.org/10.7554/eLife.57179
https://www.mikrobio.uni-kiel.de/de/institut-fuer-allgemeine-mikrobiologie
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Neues Wirkprinzip gegen Tuberkulose
Gemeinsam ist es Forschenden der Heinrich-Heine-Universität Düsseldorf (HHU) und der Universität Duisburg-Essen (UDE) gelungen, eine Gruppe von Molekülen zu identifizieren und zu synthetisieren, die auf neue Art und Weise gegen…

Gefahr durch Weltraumschrott
Neue Ausgabe von „Physikkonkret“ beleuchtet Herausforderungen und Lösungen für eine nachhaltige Nutzung des Weltraums. Die Deutsche Physikalische Gesellschaft (DPG) veröffentlicht eine neue Ausgabe ihrer Publikationsreihe „Physikkonkret“ mit dem Titel „Weltraumschrott:…

Wasserstoff: Versuchsanlage macht Elektrolyseur und Wärmepumpe gemeinsam effizient
Die nachhaltige Energiewirtschaft wartet auf den grünen Wasserstoff. Neben Importen braucht es auch effiziente, also kostengünstige heimische Elektrolyseure, die aus grünem Strom Wasserstoff erzeugen und die Nebenprodukte Sauerstoff und Wärme…





















