Wenn Nichtimmunzellen Krebszellen töten
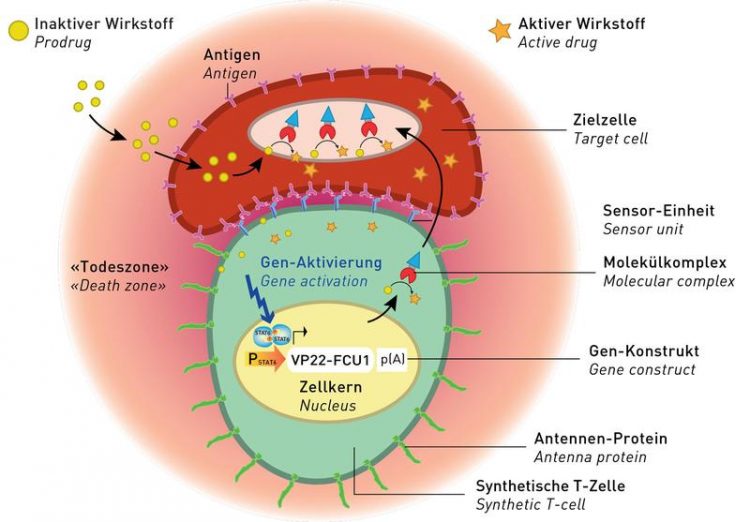
So funktionieren die künstlichen T-Zellen. ETH Zürich
Eine Hauptwaffe des Immunsystems sind T-Zellen. Diese erkennen virusbefallene Körperzellen und lösen deren programmierten Zelltod aus, was auch das Virus tötet. Bei Tumorzellen jedoch versagen die T-Zellen, da sie diese nicht als fremd erkennen und deshalb nicht eliminieren können.
Seit Kurzem setzen Ärzte allerdings nun im Labor veränderte T-Zellen gegen Tumore ein. Diesen mit zusätzlichen Funktionen ausgestatteten Immunzellen entgehen die Krebszellen nicht: Sie können Krebszellen aufspüren und abtöten. Doch diese Immunzelltherapie kann starke Nebenwirkungen haben, und die Herstellung der veränderten T-Zellen ist technisch anspruchsvoll.
Ein Team von Forschern um ETH-Professor Martin Fussenegger am Departement Biosysteme in Basel schlägt nun einen neuartigen, einfacheren Ansatz vor, um therapeutisch nutzbare synthetische Designer-Zellen zur Bekämpfung von Tumoren herzustellen: Die Forscher haben Nierenzellen und (Fett-)Stammzellen des Menschen drei zusätzliche Komponenten eingebaut und dadurch in synthetische T-Zell-ähnliche Designer-Zellen verwandelt.
Eine der Komponenten der synthetischen T-Zellen sind molekulare Antennen, die weit aus der Zelle herausragen. In der Zellmembran verankert sind zudem Antikörper mit spezifischen Andockstellen, welche Zielstrukturen der entsprechenden Krebszelle erkennen und an sie binden. Die dritte Komponente ist ein Gennetzwerk, das einen Molekülkomplex erzeugt.
Dieser Molekülkomplex besteht aus einem molekularen «Raketenkopf», der die Membran der Zielzelle durchdringt. An ihn gekoppelt ist ein Konvertermolekül, das im Inneren der Krebszelle einen Antitumor-Wirkstoff «scharf» macht.
Die Vorläufersubstanz dieses Wirkstoffs muss dem System von aussen beigefügt werden. Krebszellen nehmen diese Substanz auf und das Konvertermolekül wandelt die inaktive in eine aktive Form um. Die Krebszelle platzt, der Wirkstoff wird freigesetzt und eliminiert in der «Todeszone» rund um die synthetische T-Zelle weitere Tumorzellen. «Dieser Bystander-Effekt macht unsere synthetischen T-Zellen noch effektiver», sagt Fussenegger.
Mechanischer Auslöser
Der Mechanismus, welche die Kaskade bis zur Tötung der Krebszelle in Gang setzt, ist neu und funktioniert physikalisch: Indem die synthetische T-Zelle ihre Zielzelle nahe an sich heranzieht, verbiegen sich die Antennenproteine. Dadurch verliert die Verankerung der Antenne, die in die Zelle hineinragt, den Kontakt zu einem molekularen Schalter, den sie bis dahin blockiert. Als Reaktion auf den «An»-Befehl setzt sich eine Signalkaskade in Gang, welche die Produktion des Molekülkomplexes anschaltet.
Die neuartigen künstlichen T-Zellen haben gegenüber heutigen Krebstherapien einige Vorteile. Während bei Chemotherapien der Körper mit Wirkstoffen geflutet wird, um wenig wählerisch möglichst viele sich schnell teilende Zellen abzutöten, braucht es hier nur wenige künstliche T-Zellen. Zudem sind diese nur lokal und sehr gezielt im Einsatz.
«Unsere neuartigen T-Zellen erkennen und töten metastasierende Krebszellen zu einem sehr frühen Zeitpunkt, an dem andere Therapien nicht greifen», sagt Fussenegger. Ein weiterer Vorteil der Methode: «Die künstlichen T-Zellen arbeiten völlig unabhängig vom Immunsystem, so dass dieses weiter voll funktionstüchtig bleibt und weniger Nebenwirkungen zu erwarten sind.»
Mit Baukastensystem zur Generalisierung
Das System ist überdies baukastenartig erweiterbar. Die Forscher können die künstlichen Killerzellen mit verschiedenartigen Andockstellen, die an andere Krebszelltypen binden, ausstatten. Für die vorliegende Arbeit, die in Nature Chemical Biology erschienen ist, verwendeten die Forscher Andockstellen, die ausschliesslich einen bestimmten Typ von Brustkrebszellen erkennen. «Mit dieser Technik erzielen wir eine enorme Generalisierung, die mit den aktuell in Krebstherapien verwendeten echten T-Zellen nicht zu erreichen ist», betont Fussenegger.
Noch ist nicht bekannt, ob und wie wie dieses System im Menschen funktionieren wird. Die ETH-Forscher haben ihre neuen Zellen bislang erst in Zellkulturen getestet. «Unser neues System ist momentan weit von einer therapeutischen Anwendung entfernt», sagt der ETH-Professor. «Aber ich denke, wir haben eine neue Front gegen Krebs eröffnet.»
Literaturhinweis
Kojima R, Scheller L, Fussenegger M. Nonimmune cells equipped with T-cell-receptorlike signaling for cancer cell ablation. Nature Chemical Biology, published online 13th Nov. 2017. doi: 10.1038/nchembio.2498
https://www.ethz.ch/de/news-und-veranstaltungen/eth-news/news/2017/11/wenn-nicht…
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Diamantstaub leuchtet hell in Magnetresonanztomographie
Mögliche Alternative zum weit verbreiteten Kontrastmittel Gadolinium. Eine unerwartete Entdeckung machte eine Wissenschaftlerin des Max-Planck-Instituts für Intelligente Systeme in Stuttgart: Nanometerkleine Diamantpartikel, die eigentlich für einen ganz anderen Zweck bestimmt…

Neue Spule für 7-Tesla MRT | Kopf und Hals gleichzeitig darstellen
Die Magnetresonanztomographie (MRT) ermöglicht detaillierte Einblicke in den Körper. Vor allem die Ultrahochfeld-Bildgebung mit Magnetfeldstärken von 7 Tesla und höher macht feinste anatomische Strukturen und funktionelle Prozesse sichtbar. Doch alleine…

Hybrid-Energiespeichersystem für moderne Energienetze
Projekt HyFlow: Leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem für moderne Energienetze. In drei Jahren Forschungsarbeit hat das Konsortium des EU-Projekts HyFlow ein extrem leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem entwickelt, das einen…





















