Nicht nur sauber sondern rein: ForscherInnen zeigen, wie die "Müllabfuhr" in Zellen funktioniert
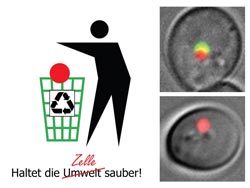
Auch Zellen müssen ihren Müll entsorgen. Der dafür zuständige Prozess – Autophagie – kann als Verpacken des Abfalls (rot) in einen Müllsack (grün) veranschaulicht werden.<br><br>Copyright: Daniel Papinski<br>
Autophagie – oder wie eine Zelle Ordnung hält
„Meister Proper putzt so sauber, dass man sich drin spiegeln kann!“ So, oder so ähnlich werden Produkte beworben, die uns das Putzen leichter machen sollen. Aber nicht nur unsere Umgebung muss sauber gehalten werden, sondern auch unsere Zellen. Der dafür verantwortliche Prozess heißt Autophagie. Ein Zusammenspiel von Proteinen sorgt dabei dafür, dass kaputte Bestandteile einer Zelle, oder Krankheitserreger, welche die Zelle befallen haben, entfernt werden. Gleichzeitig hilft die Autophagie der Zelle auch bei Nahrungsmangel, indem sie zelleigene Bestandteile recycelt und zur Energiegewinnung verwendet, ähnlich wie in einer städtischen Recyclingstation.
Der zentrale Koordinator der Autophagie: Atg1
Schon länger kennen ForscherInnen den zentralen Koordinator der Autophagie – das Protein Atg1. Bisher war jedoch nicht genau bekannt, wie Atg1 die Müllabfuhr in der Zelle genau steuert, obwohl viele WissenschaftlerInnen an diesem Thema arbeiten. Nun zeigte das Team um Claudine Kraft von den Max F. Perutz Laboratories (MFPL) der Universität Wien, dass Atg1 eine Auswahl an Proteinen modifiziert, die sich durch eine besondere Erkennungssequenz auszeichnen. In Zusammenarbeit mit den Kollegen Gustav Ammerer an den MFPL und Ben Turk an der Universität Yale entzifferte sie nicht nur diese Erkennungssequenz, sondern bestimmte auch die zellulären Proteine, die genau diese Sequenz besitzen.
Eines, Atg9, weckte das Interesse der ForscherInnen ganz besonders, da es nicht nur als Teil des zellulären „Müllsacks“ bekannt ist, sondern zudem gleich sechs der spezifischen Erkennungssequenzen besitzt. Daniel Papinski, Erstautor der Studie, erklärt: „Jede Zelle besitzt spezielle Recyclingstationen. Soll nun Abfall in der Zelle entsorgt werden, muss dieser vorher verpackt werden, er wird also sozusagen in einen Müllsack gefüllt. Dieser Müllsack kann dann zur Recyclingstation gebracht werden, wo der Inhalt in die wiederverwendbaren Bestandteile zerlegt wird.“ Für diesen Prozess ist Atg9 unerlässlich.
Wie reguliert Atg1 die Verpackung des zellulären Abfalls?
Um zu testen, wie Atg1 die Verpackung des zellulären Abfalls reguliert, modifizierten die WissenschaftlerInnen die Erkennungssequenzen von Atg9. Sie stellten fest, dass Atg1 in diesem Fall Atg9 nicht mehr modifizieren kann und daher keine Autophagie, also zelluläre Müllentsorgung, mehr stattfindet. „Dieses Szenario kam also dem in Zellen gleich, die gar keine Maschinerie zur Müllentsorgung besitzen“, sagt Claudine Kraft, Leiterin der Studie. Durch weitere Experimente konnten die ForscherInnen zeigen, dass von Atg1 modifiziertes Atg9 weitere Proteine rekrutiert, mit deren Hilfe der Abfall der Zelle verpackt und entsorgt wird. Das entscheidende und aufregendste Experiment hoben sich die ForscherInnen, wenn auch unfreiwillig, bis zum Schluss auf. Erst vor wenigen Monaten wurde eine neue Methode beschrieben, die es erlaubt, das Verpacken des zellulären Mülls live unter dem Mikroskop zu beobachten. Daniel Papinski erklärt: „Wir beobachteten Zellen, die Atg9 mit einer veränderten Erkennungssequenz enthielten, sodass es nicht mehr von Atg1 modifiziert werden konnte. Wir sahen, dass das Verpacken des Mülls vorzeitig stoppte. Die Funktion von Atg1 und Atg9 ist also für einen frühen Schritt der Müllentsorgung entscheidend, nämlich dann, wenn der Müll in „Säcke“ verpackt wird.“
Ein besseres Verständnis solcher grundlegenden zellulären Prozesse erlaubt letztlich auch, damit verbundene Krankheiten – wie im Falle der Autophagie Alzheimer und Krebs – besser zu verstehen. Auf lange Sicht wird man diese besser behandeln bzw. diesen vorbeugen können.
Originalpublikation in Molecular Cell:
Daniel Papinski, Martina Schuschnig, Wolfgang Reiter, Larissa Wilhelm, Christopher A. Barnes, Alessio Majolica, Isabella Hansmann, Thaddaeus Pfaffenwimmer, Monika Kijanska, Ingrid Stoffel, Sung Sik Lee, Andrea Brezovich, Jane Hua Lou, Benjamin E. Turk, Ruedi Aebersold, Gustav Ammerer, Matthias Peter, and Claudine Kraft: Early steps in autophagy depend on direct phosphorylation of Atg9 by the Atg1 kinase. In: Molecular Cell (Jänner 2014).
DOI: http://dx.doi.org/10.1016/j.molcel.2013.12.011 (sobald online)
Max F. Perutz Laboratories
Die Max F. Perutz Laboratories (MFPL) sind ein gemeinsames Forschungs- und Ausbildungszentrum der Universität Wien und der Medizinischen Universität Wien am Campus Vienna Biocenter. An den MFPL sind rund 500 WissenschaftlerInnen in über 60 Forschungsgruppen mit Grundlagenforschung im Bereich der Molekularbiologie beschäftigt.
Wissenschaftlicher Kontakt
Dr. Claudine Kraft
Max F. Perutz Laboratories
Department für Medizinische Biochemie
Universität Wien
T +43-1-4277-616 52
claudine.kraft@univie.ac.at
Rückfragehinweis
Dr. Lilly Sommer
Max F. Perutz Laboratories
Communications
T +43-1-4277-240 14
lilly.sommer@mfpl.ac.at
Weitere Informationen:
DOI: http://dx.doi.org/10.1016/j.molcel.2013.12.011
Media Contact
Weitere Informationen:
http://www.univie.ac.atAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Diamantstaub leuchtet hell in Magnetresonanztomographie
Mögliche Alternative zum weit verbreiteten Kontrastmittel Gadolinium. Eine unerwartete Entdeckung machte eine Wissenschaftlerin des Max-Planck-Instituts für Intelligente Systeme in Stuttgart: Nanometerkleine Diamantpartikel, die eigentlich für einen ganz anderen Zweck bestimmt…

Neue Spule für 7-Tesla MRT | Kopf und Hals gleichzeitig darstellen
Die Magnetresonanztomographie (MRT) ermöglicht detaillierte Einblicke in den Körper. Vor allem die Ultrahochfeld-Bildgebung mit Magnetfeldstärken von 7 Tesla und höher macht feinste anatomische Strukturen und funktionelle Prozesse sichtbar. Doch alleine…

Hybrid-Energiespeichersystem für moderne Energienetze
Projekt HyFlow: Leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem für moderne Energienetze. In drei Jahren Forschungsarbeit hat das Konsortium des EU-Projekts HyFlow ein extrem leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem entwickelt, das einen…





















