Faltungsprotein bindet für Alzheimer verantwortliches Protein: Gefährliche Verwechslung
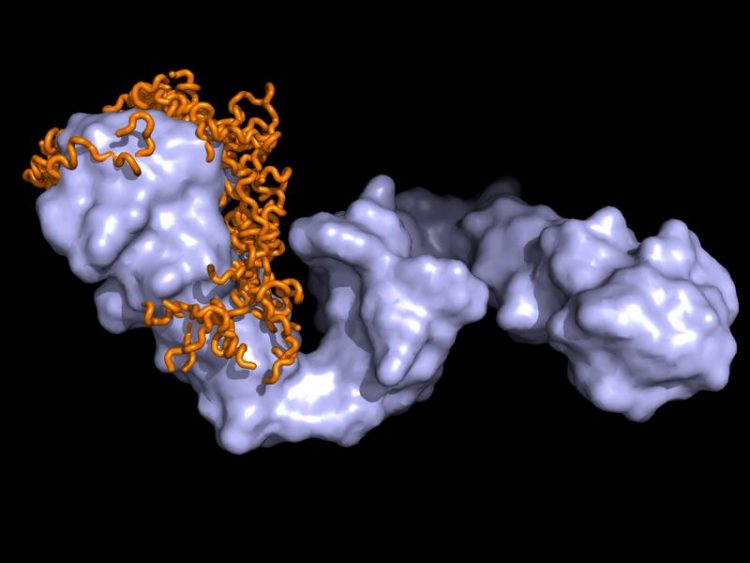
NMR/SAXS Strukturmodell des Hsp90-Tau Proteinkomplexes (Hellblau - Hsp90, Orange - Tau) Bild: Tobias Madl / TUM/HMGU
Proteine, wie das sogenannte Hitzeschockprotein Hsp90, spielen eine wichtige Rolle bei fast allen Prozessen in menschlichen Zellen. Sie helfen dabei, andere Proteine in ihre dreidimensionale Form zu falten oder geschädigte Proteine wieder in die korrekte Form zurück zu bringen.
In letzter Zeit hatten sich die Hinweise darauf verdichtet, dass das Hitzeschock-Protein Hsp90 auch an Faltungsprozessen des Tau-Proteins beteiligt ist. Ablagerungen von Tau-Proteinen in Gehirnzellen sind typisch für Morbus Alzheimer und werden für das Absterben von Nervenzellen verantwortlich gemacht.
Doch während das Tau-Protein in Lösung eher einer lang gestreckten Kette gleicht, bindet das HSP90 bevorzugt bereits gefaltete Proteine. Diesen Widerspruch konnte jetzt ein internationales Team um Dr. Tobias Madl, BioSysNet Nachwuchsgruppenleiter und TUM Junior Fellow an der Technischen Universität München und Leiter der Emmy Noether Arbeitsgruppe Strukturbiologie der Signaltransduktion am Institut für Strukturbiologie am Helmholtz Zentrum München sowie Prof. Stefan Rüdiger von der niederländischen Universität Utrecht aufklären.
Mit einer Kombination verschiedenster Methoden, wie Kernresonanzspektroskopie, Röntgenkleinwinkelstreuung und Computer-Modellierung, gelang es ihnen, Dynamik und Struktur der Biomoleküle zu bestimmen. Daraus konnten sie ableiten, wie Hsp90 das Tau-Protein erkennt und an sich bindet: Für das Hsp90 sieht das Tau-Protein aus, wie ein vorgefaltetes größeres Protein. Diese Proteinstruktur gibt auch Aufschluss darüber, wie Hsp90 die Aggregation von Tau-Proteinen miteinander beeinflusst.
„Ablagerungen von Tau-Proteinen können die Alzheimer-Krankheit verursachen. Wir haben diejenige Proteinregion entdeckt, an der die Proteine interagieren. Dies ist ein neuartiger und wichtiger Ansatzpunkt, um die Strukturbildung zu beeinflussen und daraus künftige Therapien zu entwickeln.“ erklärt Madl.
Neben Morbus Alzheimer werden weitere neurodegenerative Erkrankungen durch Proteinaggregationen verursacht. Auch bei der Entstehung von Krebs und Cystischer Fibrose spielen die Chaperone eine Rolle. Die wissenschaftlichen Erkenntnisse liefern daher wichtige Grundlagen für ein besseres Verständnis der Krankheitsmechanismen.
Die Arbeiten wurde gefördert aus Mitteln der Europäischen Gemeinschaft, der Deutschen Forschungsgemeinschaft (DFG), der Niederländischen Organisation für Wissenschaftliche Forschung (NWO), der österreichischen Akademie der Wissenschaften, der portugiesischen Fundação para a Ciência e a Tecnologia, der National Insitutes of Health (USA) sowie des Bayerischen Wissenschaftsministeriums. Die Röntgen-Kleinwinkelstreuungsexperimente (SAXS) wurden in der Außenstation des EMBL am DESY in Hamburg durchgeführt. Die Computer-Modellierungen wurden am Leibniz-Rechenzentrum der Bayerischen Akademie der Wissenschaften durchgeführt.
Original Publikation:
Karagoz, G. E. et al. (2014), Hsp90-Tau Complex Reveals Molecular Basis for Specificity in Chaperone Action. Cell, 156, (5), 963-974 Doi: 10.1016/j.cell.2014.01.037
Kontakt:
Dr. Tobias Madl
BioSysNet & Emmy Noether Forschungsgruppenleiter
Technische Universität München Fakultät für Chemie
Lichtenbergstr. 4, 85748 Garching Germany
Tel.: +49 89 289 13018 – E-Mail: t.madl@tum.de
http://www.madllab.ch.tum.de/
http://www.cell.com/abstract/S0092-8674%2814%2900089-0
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Diamantstaub leuchtet hell in Magnetresonanztomographie
Mögliche Alternative zum weit verbreiteten Kontrastmittel Gadolinium. Eine unerwartete Entdeckung machte eine Wissenschaftlerin des Max-Planck-Instituts für Intelligente Systeme in Stuttgart: Nanometerkleine Diamantpartikel, die eigentlich für einen ganz anderen Zweck bestimmt…

Neue Spule für 7-Tesla MRT | Kopf und Hals gleichzeitig darstellen
Die Magnetresonanztomographie (MRT) ermöglicht detaillierte Einblicke in den Körper. Vor allem die Ultrahochfeld-Bildgebung mit Magnetfeldstärken von 7 Tesla und höher macht feinste anatomische Strukturen und funktionelle Prozesse sichtbar. Doch alleine…

Hybrid-Energiespeichersystem für moderne Energienetze
Projekt HyFlow: Leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem für moderne Energienetze. In drei Jahren Forschungsarbeit hat das Konsortium des EU-Projekts HyFlow ein extrem leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem entwickelt, das einen…





















