Erkennen und transportieren: faszinierende Multitasking-Proteine
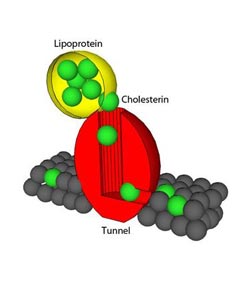
Bildunterschrift: Das vereinfachte Modell zeigt, wie Membranproteine das Cholesterin an die Zellmembran transportieren. Foto/Copyright: J. Peters/CAU<br>
Die besondere Funktion eines dieser Proteine, LIMP-2, haben Wissenschaftlerinnen und Wissenschaftler vom Biochemischen Institut, Medizinische Fakultät, der Christian-Albrechts-Universität zu Kiel (CAU) zusammen mit Kolleginnen und Kollegen aus Bielefeld und Kanada, jetzt erstmals beschrieben. Die Ergebnisse ihrer Studie erschienen gestern, 27.Oktober, in der renommierten Fachzeitschrift Nature.
Die Biochemikerinnen und Biochemiker konnten mit ihren Experimenten den genauen räumlichen Aufbau des Membranproteins LIMP-2 aufklären. Dieses Ergebnis half ihnen, auch die lang gesuchte Struktur zweier eng verwandter Proteine (SR-B1 und CD36) erstmals zu beschreiben.
„Diese beiden Proteine sind wichtige Rezeptoren an unseren Zellmembranen und von entscheidender Bedeutung für krankmachende Prozesse wie Alzheimer, Demenz, Arterienverkalkung und bei Diabetes“, erklärt Professor Paul Saftig vom Biochemischen Institut der CAU. Man habe zwar geahnt, dass sie bestimmte Fette und insbesondere Cholesterin an die Zellmembranen weiterleiten müssen, wie diese Proteine das tatsächlich vermitteln können, habe man aber nicht gewusst, sagt der Biochemiker.
Die Auflösung der Struktur der Membranproteine ergab nun zwei überraschende Befunde. Zum einen formen diese Proteine einen Tunnel, durch den Cholesterin an die Membran transportiert werden kann. Blockieren Wissenschaftlerinnen und Wissenschaftler den Tunnel, so kann die Zelle kein Cholesterin aufnehmen. Zum anderen verstehen sie nun erstmals, wie diese Rezeptoren andere Proteine, zum Beispiel fettspaltende Enzyme oder mit Fett gefüllte Blutproteine (Lipoproteine), erkennen und binden können.
„Faszinierend ist dabei, dass die Natur es geschafft hat, solche ‚Multitasking‘ Proteine zu entwickeln, die auf der einen Seite fetttragende Proteine binden und zum anderen die Fette dann unmittelbar durch ein Tunnelsystem an die richtige Stelle transportieren können“, erklärt Saftig.
An den mehrjährigen Experimenten waren neben Professor Paul Saftig auch Privatdozent Dr. Michael Schwake, jetzt Universität Bielefeld, sowie die Doktorandinnen Friederike Zunke und Judith Peters vom Biochemischen Institut der CAU beteiligt. Die grundlegenden neuen Erkenntnisse tragen zukünftig zur Entwicklung neuartiger Therapeutika, die zum Beispiel die Cholesterinaufnahme beeinflussen, bei.
Originalpublikation:
Dante Neculai, Michael Schwake, Mani Ravichandran, Friederike Zunke, Richard Collins, Judith Peters, Mirela Neculai, Jonathan Plumb, Peter Loppnau, Juan Carlos Pizarro, Alma Seitova, William S. Trimble, Paul Saftig, Sergio Grinstein, Sirano Dhe-Paganon: Structure of LIMP-2 provides functional insights with implications for SR-BI and CD36, Nature
doi.org/ 10.1038/nature12684
Kontakt:
Prof. Paul Saftig
Telefon: 0431/880-2216
E-Mail: psaftig@biochem.uni-kiel.de
Media Contact
Weitere Informationen:
http://www.uni-kiel.deAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Robotisch assistiertes Laserverfahren soll OP-Risiken minimieren
Eine Spinalkanalstenose – eine knöcherne Verengung des Wirbelkanals – kann für Betroffene zur Qual werden. Drückt sie auf das Rückenmark, drohen ihnen chronische Schmerzen und Lähmungserscheinungen. Häufig hilft dann nur…

Verbesserte Materialien für die Verbindungen von Mikrochips
Leistungsfähiger, stromsparender, komplexer – Hersteller von modernen Microchips sehen sich stetig neuen Herausforderungen gegenüber, auch in Bezug auf die dort notwendigen elektrischen Verbindungen. Das Fraunhofer IPMS und BASF widmen sich…

Inspiriert von der Natur: Biophysiker aus dem Projekt InCamS@BI entwickelt neuartige Mikroplastikfilter im Labor
Heutzutage ist es überall zu finden: Mikroplastik. Es wird insbesondere durch die Luft und durchs Wasser in die entlegensten Winkel der Erde transportiert. Eine der großen Fragen lautet: Wie können…



