Die Rolle von ATP bei Alzheimer oder Parkinson
Mehringer et al., Hofmeister versus Neuberg: is ATP really a biological hydrotrope?, Cell Reports Physical Science (2021), https://doi.org/10.1016/j.xcrp.2021.100343 Lizenz: CC BY-NC-ND 2.0 https://creativecommons.org/licenses/by-nc-nd/2.0/
Chemiker:innen finden komplexes Wechselspiel verschiedener Phänomene.
Das Molekül Adenosintriphosphat, kurz ATP, ist als Energiewährung lebender Zellen bekannt und spielt eine wichtige Rolle für die Funktion vieler molekularer Maschinen im Körper. So ermöglicht ATP die Kontraktion von Muskelgewebe oder das Pumpen von Ionen durch Zellmembrane. Erstaunlicherweise ist die zelluläre Konzentration an ATP aber erheblich größer als für diese Funktion unmittelbar erforderlich, daher gibt es seit geraumer Zeit Vermutungen über weitere, sekundäre Funktionen. Dabei fiel das Augenmerk auf den Einfluss von ATP auf die Stabilität und das Aggregationsverhalten von Proteinen in Zellen.
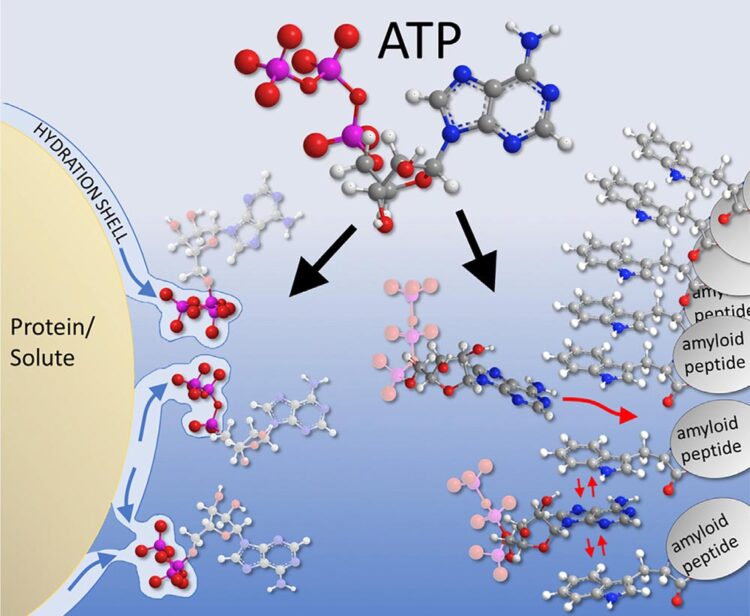
Im Adenosin hat ATP unpolare, hydrophobe Gruppen, während die Triphosphatgruppe sehr gut wasserlöslich ist. Aufgrund dieser „amphiphilen“ Struktur wurde von Wissenschaftlern um Avinash Patel und Anthony Hyman in Dresden in einer 2017 in Science erschienenen Veröffentlichung angenommen, dass ATP eine tensidähnliche, 1916 von dem Biochemiker Carl Neuberg als „Hydrotropie“ bezeichnete, Wirkung zeigt. Damit könnte die beobachtete Stabilisierung von aggregationsanfälligen Proteinen, wie sie zum Beispiel für neurodegenerative Erkrankungen wie Alzheimer eine Rolle spielen, erklärt werden.
Eine Gruppe Chemiker:innen um die Doktoranden Johannes Mehringer und Tuan-Minh Do am Institut für Physikalische und Theoretische Chemie der Universität Regensburg hat jetzt den tatsächlichen Wirkmechanismus von ATP bei solchen Proteinen aufgeklärt und gezeigt, dass eine klassische Hydrotropie nicht vorliegt, sondern es sich um ein komplexes Wechselspiel verschiedener Effekte und Phänomene handelt.
Für viele Proteine ist eine Umlagerung zu einer β-faltblattreichen Konformation der erste Schritt zur Aggregation bzw. Fibrillierung. Dabei lagern sich mehrere derartig fehlgefaltete Peptide zu großen Aggregaten zusammen, die oft eine faserartige, als Amyloid bekannte, Struktur annehmen. Dieser Vorgang wird in Verbindung mit einer Reihe von Erkrankungen wie Alzheimer oder Parkinson gebracht. ATP kann hier eine Aggregation zum Teil unterdrücken, indem sich der Adenin-Teil des Moleküls zwischen die Strukturen schiebt.
Eine Wechselwirkung zwischen den elektronischen π-Systemen in Adenin bzw. in den β-Faltblättern spielt hier die entscheidende Rolle. Für diesen Effekt ist der amphiphile Charakter des ATPs nicht maßgeblich, sodass eine tensidartige Wirkung ausgeschlossen scheint. Dagegen haben die von Franz Hofmeister entdeckten spezifischen Ioneneffekte und die starke Hydratisierung der Phosphatgruppen einen weiteren wichtigen Einfluss.Um zu diesen Erkenntnissen zu kommen, erwies sich die Kombination aus detaillierten Computersimulationen in der Arbeitsgruppe Horinek mit einer Vielzahl von Experimenten in der Arbeitsgruppe Kunz als überaus fruchtbar. Die Ergebnisse wurden vor kurzem in der Zeitschrift Cell Reports Physical Science veröffentlicht. Basierend auf der Aufklärung des Wirkmechanismus werden derzeit am Lehrstuhl von Professor Dr. Werner Kunz in Kooperation mit dem Lehrstuhl von Professor Dr. Stephan Schneuwly aus der Biologie weitere Moleküle getestet, die eventuell eine Fibrillierung und damit vielleicht den Ausbruch von neurodegenerativen Krankheiten verhindern oder verlangsamen könnten.
Originalpublikation
Johannes Mehringer, Tuan-Minh Do, Didier Touraud, Max Hohenschutz, Ali Khoshsima, Dominik Horinek und Werner Kunz, Hofmeister versus Neuberg: is ATP really a biological hydrotrope?, in: Cell Reports Physical Science (2021).
DOI: https://doi.org/10.1016/j.xcrp.2021.100343
Weiterführende Informationen
- Webseite von Prof. Dr. Werner Kunz
- Webseite von Prof. Dr. Dominik Horinek
- Webseite von Prof. Dr. Stephan Schneuwly
- Webseite der „Graduate Students“ am Lehrstuhl von Prof. Kunz
Ansprechpartner für die Medien
Prof. Dr. Werner Kunz
Universität Regensburg
Institut für Physikalische und Theoretische Chemie
Telefon +49 941 943-4296
E-Mail werner.kunz@ur.de
Prof. Dr. Dominik Horinek
Universität Regensburg
Institut für Physikalische und Theoretische Chemie
Telefon +49 941 943-4745
E-Mail dominik.horinek@ur.de
https://www.uni-regensburg.de/pressearchiv/pressemitteilung/1102414.html
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Diamantstaub leuchtet hell in Magnetresonanztomographie
Mögliche Alternative zum weit verbreiteten Kontrastmittel Gadolinium. Eine unerwartete Entdeckung machte eine Wissenschaftlerin des Max-Planck-Instituts für Intelligente Systeme in Stuttgart: Nanometerkleine Diamantpartikel, die eigentlich für einen ganz anderen Zweck bestimmt…

Neue Spule für 7-Tesla MRT | Kopf und Hals gleichzeitig darstellen
Die Magnetresonanztomographie (MRT) ermöglicht detaillierte Einblicke in den Körper. Vor allem die Ultrahochfeld-Bildgebung mit Magnetfeldstärken von 7 Tesla und höher macht feinste anatomische Strukturen und funktionelle Prozesse sichtbar. Doch alleine…

Hybrid-Energiespeichersystem für moderne Energienetze
Projekt HyFlow: Leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem für moderne Energienetze. In drei Jahren Forschungsarbeit hat das Konsortium des EU-Projekts HyFlow ein extrem leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem entwickelt, das einen…





















