Antikörpercharakterisierung mit SPR-Chiptechnologie
Der Einsatz von Biosensoren basierend auf Oberflächen Plasmonresonanz (surface plasmon resonance SPR) ist ein exzellentes Werkzeug für markierungsfreie Echtzeituntersuchungen beliebiger biomolekularer Wechselwirkungen (biomolecular interaction analysis BIA) unter minimalem Probenverbrauch. Ein entscheidender Vorteil von kinetischen Analysen mit SPR basierten Biosensoren gegenüber der klassischen steady-state-Analyse ist die separate Bestimmung von Assoziations- und Dissoziationsgeschwindigkeitskonstanten. Vielfältige biologische Anwendungen inklusive einer detaillierten Analyse von Antigen-Antikörper-Wechselwirkungen sind möglich. Das folgende Anwendungsbeispiel aus dem Bereich der Antikörpercharakterisierung soll einen kurzen Überblick über die technischen Möglichkeiten der SPR-Technologie geben.
Die kinetische Charakterisierung der Bindungseigenschaften von Antikörpern und deren Antigenen ist eine wesentliche Voraussetzung, um ihre Anwendbarkeit für verschiedene Methoden bewerten zu können. Neben der Bindungsstärke (Affinität, KD-Wert) werden auch die Geschwindigkeitskonstanten für Assoziation (kass) und Dissoziation (kdiss) bestimmt. Damit sind auch Aussagen über die Geschwindigkeit der Komplexbildung und des Komplexzerfalls möglich. Diese Informationen werden benötigt, um die Effizienz der Antikörper in diagnostischen, biotechnologischen oder therapeutischen Anwendungen beurteilen und Prozesse in deren Anwendung optimieren zu können.
Qualitatives Ranking
Ein qualitatives Ranking von Antikörpern, die gegen das gleiche Antigen gerichtet sind, ermöglicht eine schnelle Selektion von Antikörpern mit bestimmten Bindungseigenschaften.
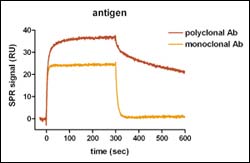
Ein qualitativer Antikörper-Screen beginnt mit der spezifischen Kopplung der Antikörper auf einer Biosensor Fängeroberfläche. Für die Analyse der Interaktion wird das Antigen über die Antikörperoberfläche gegeben, wobei die spezifische Interaktion nach Abzug einer Referenzmeßzelle als positives Assoziationssignal detektierbar ist (erste 300 Sekunden in Abb.1). Danach wird auf Laufpuffer ohne Antigen umgeschaltet. Die Abnahme des Meßsignals korreliert mit der Dissoziation gebundenen Antigens von der Antikörperoberfläche (300-600 Sekunden in Abb.1). Nach anschließender Regeneration der Fängeroberfläche ist eine erneute Antigen-Injektion möglich.
Quantitative Analysen
Eine quantitative Analyse der Bindungseigenschaften von Antikörpern und deren Antigenen ermöglicht eine detaillierte kinetische Bewertung im Hinblick auf deren Einsatz in verschiedenen Prozessen.
Für quantitative Messungen wird der Antikörper auf einer Biosensor Fängeroberfläche spezifisch gekoppelt und anschließend die Interaktion des Antigens mit dem Antikörper analysiert. Es wird eine komplette Konzentrationsreihe des Antigens nach Regeneration der Chipoberfläche analysiert (siehe Abb.2).
In erster Näherung eignet sich für die Auswertung das 1:1 Langmuir Modell zur Berechnung der Affinitäten (KD-Wert) und der Geschwindigkeitskonstanten für die Assoziation (kass) und die Dissoziation (kdiss). Im Anschluß daran kann eine Optimierung der Versuchsbedingungen hinsichtlich unspezifischer Bindung, Pufferbedingungen, Zeit für Assoziation und Dissoziation sowie des eingesetzten Konzentrationsbereiches für das Antigen vorgenommen werden. Sollten die Bindungskurven nicht einem 1:1 Bindungsmodell entsprechen, ist die Auswertung zur Bestimmung der kinetischen Daten unter Anwendung komplexerer kinetischer Modelle möglich.
Vielfältige Möglichkeiten
Neben dem qualitativen Ranking, das eine schnelle Selektion von Antikörpern mit bestimmten Bindungseigenschaften erlaubt, und der detaillierten quantitativen Analyse zur Ermittlung der genauen Werte von Affinität (KD-Wert) und den einzelnen Geschwindigkeitskonstanten für Assoziation (kass) und Dissoziation (kdiss) sind noch weitere individuellere Anwendungsbeispiele denkbar.
So kann z.B. die Qualität verschiedener Antikörper gegen ein erweitertes Epitop in Bindungsstudien charakterisiert werden. Die Bindung eines RGS-His-Fusionsproteins an immobilisierte Antikörper gegen Tetra-His, Penta-His und RGS-His ist in Abb.3 gezeigt.
Weitere Anwendungen sind:
· Prozess- und Qualitätskontrolle während der Antikörperherstellung
· Stabilitätsuntersuchungen bei unterschiedlichen Assaybedingungen (basierend auf Konzentrationsbestimmungen)
· Detektion und Quantifizierung von Antikörper-Markern in diagnostischen Anwendungen
· akkurate Bestimmung des Antikörpergehalts in Seren (Immunoreaktivität)
· Untersuchung unspezifischer Bindung an Antikörper
· Cross-Reaktivität von Antikörpern
· Spezifität des Antikörpers gegenüber einem bestimmten Antigen oder eines bestimmten Bindungsepitops
Media Contact
Weitere Informationen:
http://www.biaffin.deAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Neue universelle lichtbasierte Technik zur Kontrolle der Talpolarisation
Ein internationales Forscherteam berichtet in Nature über eine neue Methode, mit der zum ersten Mal die Talpolarisation in zentrosymmetrischen Bulk-Materialien auf eine nicht materialspezifische Weise erreicht wird. Diese „universelle Technik“…

Tumorzellen hebeln das Immunsystem früh aus
Neu entdeckter Mechanismus könnte Krebs-Immuntherapien deutlich verbessern. Tumore verhindern aktiv, dass sich Immunantworten durch sogenannte zytotoxische T-Zellen bilden, die den Krebs bekämpfen könnten. Wie das genau geschieht, beschreiben jetzt erstmals…

Immunzellen in den Startlöchern: „Allzeit bereit“ ist harte Arbeit
Wenn Krankheitserreger in den Körper eindringen, muss das Immunsystem sofort reagieren und eine Infektion verhindern oder eindämmen. Doch wie halten sich unsere Abwehrzellen bereit, wenn kein Angreifer in Sicht ist?…





















