Türöffner für Metastasen
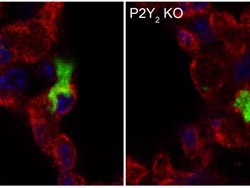
Eine Tumorzelle durchbricht die Endothelbarriere: Im linken Bild ist es der grün gefärbten Tumorzelle gelungen, die rot gefärbte Endothelzellbarriere zu durchbrechen. Im Gegensatz dazu bleibt in der rechten Abbildung die Tumorzelle innerhalb des Blutgefäßes, dessen Endothelzellen im Unterschied zu den Endothelzellen links der P2Y2-Rezeptor fehlt, haften (blau: Zellkerne).<br><br>© MPI f. Herz- und Lungenforschung<br>
Bösartige Tumoren streuen oftmals in entfernte Bereiche des Körpers. Diese Bildung von Metastasen läuft in den meisten Fällen über das Blutgefäßsystem. Blutplättchen werden dabei zum wichtigen Helfer der Tumorzellen, um in neue Organe vorzudringen.
Wissenschaftler vom Max-Planck-Institut für Herz- und Lungenforschung in Bad Nauheim haben auf den Zellen der Blutgefäßwand das Rezeptormolekül P2Y2 identifiziert, das den Krebszellen den Weg in die Organe öffnet. Ziel ist es nun, durch die gezielte Blockade der Schlüsselmoleküle die Bildung von Metastasen zu unterdrücken.
Blutplättchen spielen bei der Blutstillung eine entscheidende Rolle. Bei einer Verletzung der Blutgefäße sorgen sie für den schnellen, ersten Wundverschluss. Dabei heften sie sich in kürzester Zeit an der verletzten Gefäßwand an. Weitere Plättchen werden angelockt und verklumpen zu einem Pfropf, der die Gefäßwunde verschließt. Damit diese „schnelle Eingreiftruppe“ der Blutstillung optimal funktionieren kann, wird im Falle einer Verletzung von Gefäßwandzellen von Blutplättchen geradezu ein Feuerwerk an Signalmolekülen abgeschossen. Auf diese Weise kommunizieren die Zellen untereinander. Zudem werden die normalerweise inaktiv im Blutstrom zirkulierenden Plättchen innerhalb von Sekunden aktiviert und ändern ihre Eigenschaften grundlegend.
Bösartige Tumoren, die oftmals über den Blutstrom in bisher noch nicht befallene Organe streuen, nutzen dabei die Blutplättchen für die Passage der eigentlich hermetisch abgeriegelten Blutgefäßwand. „Schon seit Längerem ist bekannt, dass metastasierende Tumorzellen in der Lage sind, mit Blutplättchen in engen Kontakt zu treten und diese zu aktivieren. Tierexperimentelle Untersuchungen haben gezeigt, dass Tumorzellen in Abwesenheit von Blutplättchen wesentlich weniger Metastasen bilden“, sagt Stefan Offermanns, Direktor der Abteilung Pharmakologie am Bad Nauheimer Max-Planck-Institut. Zudem haben klinische Studien ergeben, dass Patienten, die langfristig mit Blutplättchen-Hemmern wie Acetylsalicylsäure (ASS) behandelt worden waren, ein geringeres Risiko für metastasierende Tumoren besaßen.
Wie dies im Detail abläuft, konnte die Arbeitsgruppe von Offermanns nun klären. Aktivierte Blutplättchen setzen eine Vielzahl von Molekülen frei, darunter auch das Adenosin-Triphosphat (ATP). In Zellkulturen zeigte sich, dass eine Blockade der ATP-Freisetzung aus Blutplättchen dazu führt, dass viel weniger Tumorzellen durch die Endothelzellen der Gefäßwand hindurch wanderten. „Gleiches konnten wir in Experimenten an Mäusen zeigen, bei denen die Freisetzung von ATP aus Blutplättchen gestört war. Auch in diesem Fall schlüpften viel weniger Tumorzellen durch die Endothelbarriere, und es bildeten sich weniger Metastasen“, so Dagmar Schuhmacher, eine der Erstautorinnen der Studie.
Doch was geschieht in der Blutgefäßwand, damit diese für Tumorzellen durchlässig wird? Die Max-Planck-Forscher konnten zeigen, dass ATP aus den Blutplättchen an einen bestimmten Rezeptor mit dem Namen P2Y2 bindet. Diese Andockstelle befindet sich auf der Oberfläche der Endothelzellen. „Bindet ATP an diesen Rezeptor, bilden sich anschließend zwischen den einzelnen Endothelzellen kleine Öffnungen. Durch diese verlassen die Tumorzellen das Blutgefäß und wandern in das Organ ein“, erläutert Boris Strilic, ebenfalls Erstautor der Studie.
Mit der Identifizierung dieser bisher noch unbekannten Funktion von Blutplättchen bei der Metastasenbildung hoffen die Forscher nun neue therapeutische Ansatzpunkte gefunden zu haben. „Wir werden nun testen, ob spezifische Blocker für den P2Y2-Rezeptor oder Stoffe, die die ATP-Freisetzung aus Blutplättchen hemmen, die Tumorzell-Metastasierung in verschiedenen Tiermodellen unterdrücken können“, sagt Offermanns. Die besondere Herausforderung dabei ist es, die eigentliche Aufgabe der Plättchen, nämlich die Blutstillung, nicht zu unterdrücken. Sollte dies gelingen, wäre zukünftig eine bessere Behandlung bösartiger Tumoren möglich.
Ansprechpartner
Prof. Dr. Stefan Offermanns
Max-Planck-Institut für Herz- und Lungenforschung, Bad Nauheim
Telefon: +49 6032 705-1202
Fax: +49 6032 705-1204
E-Mail: stefan.offermanns@mpi-bn.mpg.de
Dr. Matthias Heil
Max-Planck-Institut für Herz- und Lungenforschung, Bad Nauheim
Telefon: +49 6032 705-1705
Fax: +49 6032 705-1704
E-Mail: matthias.heil@mpi-bn.mpg.de
Originalpublikation
Dagmar Schumacher, Boris Strilic, Kishor Kumar Sivaraj, Nina Wettschureck, Stefan Offermanns
Platelet-derived nucleotides promote tumor-cell transendothelial migration and metastasis via P2Y2-receptor.
Cancer Cell (2013)
Media Contact
Weitere Informationen:
http://www.mpg.de/7424912/metastasierende_krebszellenAlle Nachrichten aus der Kategorie: Medizin Gesundheit
Dieser Fachbereich fasst die Vielzahl der medizinischen Fachrichtungen aus dem Bereich der Humanmedizin zusammen.
Unter anderem finden Sie hier Berichte aus den Teilbereichen: Anästhesiologie, Anatomie, Chirurgie, Humangenetik, Hygiene und Umweltmedizin, Innere Medizin, Neurologie, Pharmakologie, Physiologie, Urologie oder Zahnmedizin.
Neueste Beiträge

Diamantstaub leuchtet hell in Magnetresonanztomographie
Mögliche Alternative zum weit verbreiteten Kontrastmittel Gadolinium. Eine unerwartete Entdeckung machte eine Wissenschaftlerin des Max-Planck-Instituts für Intelligente Systeme in Stuttgart: Nanometerkleine Diamantpartikel, die eigentlich für einen ganz anderen Zweck bestimmt…

Neue Spule für 7-Tesla MRT | Kopf und Hals gleichzeitig darstellen
Die Magnetresonanztomographie (MRT) ermöglicht detaillierte Einblicke in den Körper. Vor allem die Ultrahochfeld-Bildgebung mit Magnetfeldstärken von 7 Tesla und höher macht feinste anatomische Strukturen und funktionelle Prozesse sichtbar. Doch alleine…

Hybrid-Energiespeichersystem für moderne Energienetze
Projekt HyFlow: Leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem für moderne Energienetze. In drei Jahren Forschungsarbeit hat das Konsortium des EU-Projekts HyFlow ein extrem leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem entwickelt, das einen…