Zellulärer Systemabsturz verursacht Alzheimer
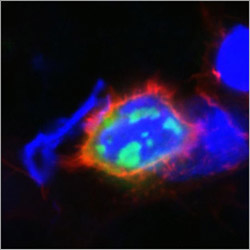
Toxische Proteinaggregate können neurodegenerative Krankheiten verursachen. In rot dargestellt ist die Zellhülle, blau das Zellinnere und grün die toxischen Aggregate. Bild: Heidi Olzscha<br>
Wenn Proteine miteinander verklumpen, kann das neurodegenerative Krankheiten wie Alzheimer, Huntington oder Parkinson zur Folge haben. Wissenschaftler am Max-Planck-Institut für Biochemie (MPIB) in Martinsried bei München haben jetzt einen wichtigen Mechanismus aufgedeckt, der klärt, wie und warum für die Zelle giftige Proteinaggregate entstehen und welche Proteine dafür anfällig sind. „Nicht alle Proteine sind betroffen“, sagt Heidi Olzscha, Doktorandin am MPIB. „Nur solche, die bestimmte strukturelle Eigenschaften aufweisen und deshalb wichtige biologische Funktionen erfüllen.“ (Cell, 7. Januar 2010)
Um ihre verschiedenen Funktionen im Körper wahrnehmen zu können, müssen Proteine korrekt gefaltet sein und die richtige dreidimensionale Struktur besitzen. Dafür sorgen Chaperone, die „molekularen Anstandsdamen“ der Zelle. Erfüllen sie ihre Aufgabe nicht, sind Fehlfaltungen oder ein Verklumpen der Proteine die Folge, was wiederum zu neurodegenerativen Erkrankungen wie Alzheimer, Huntington oder Parkinson führen kann. Alzheimer etwa entsteht, weil die sich bildenden Proteinaggregate toxisch auf Nervenzellen wirken und diese absterben lassen. Nach Angaben von Alzheimer Forschung Initiative e.V. leiden in Deutschland schätzungsweise 1,2 Millionen Menschen an dieser Krankheit, wobei das Risiko mit steigendem Alter zunimmt.
Wissenschaftler der Abteilung Zelluläre Biochemie am Max-Planck-Institut für Biochemie, die von F.-Ulrich Hartl geleitet wird, haben jetzt herausgefunden, wie Proteine zu Aggregaten verklumpen und warum das für Zellen schädlich ist. Im Reagenzglas haben sie künstliche Proteine ohne biologische Funktionen generiert und in Zellen eingeschleust. Diese verklumpten, zogen viele natürliche Proteine der Zelle in die Aggregate hinein und störten so deren Funktion. Mithilfe quantitativer Methoden der Proteomik konnten die Wissenschaftler zudem herausfinden, dass die betroffenen Proteine bestimmte strukturelle Eigenschaften gemeinsam haben, die eine Aggregation erst ermöglichen: Sie sind groß, besitzen mehrere Funktionsbereiche und weisen eine erhebliche, ungeordnete Struktur auf.
„Hierbei handelt es sich um Proteine, die nicht nur viele, sondern vor allem äußerst wichtige Funktionen in der Zelle erfüllen“, erklärt Martin Vabulas. „So sind sie beispielsweise für die Organisation und Stabilität innerhalb der Zelle, die Umwandlung von DNA in RNA oder die Herstellung von Proteinen verantwortlich. Werden mehrere dieser essentiellen zellulären Funktionen gleichzeitig gestört, führt das zum zellulären Systemabsturz. Krankheiten wie Alzheimer, Huntington oder Parkinson sind die Folge.“
Eine erhöhte Bildung von Chaperonen könnte diese Proteinaggregationen verhindern. Die Chaperone schirmen die Aggregate ab, sodass sie nicht mehr mit anderen Proteinen in Kontakt treten können. Dies könnte ein möglicher Ansatzpunkt im Kampf gegen neurodegenerative Krankheiten sein und helfen, Alzheimer, Huntington oder Parkinson schon von vornherein zu verhindern, hoffen die Wissenschaftler.
Originalveröffentlichung:
H. Olzscha, S. M. Schermann, A. C. Woerner, S. Pinkert, M. H. Hecht, G. G. Tartaglia, M. Vendruscolo, M. Hayer-Hartl, F.-U. Hartl und R. M. Vabulas
Amyloid-like Aggregates Sequester Numerous Metastable Proteins with Essential Cellular Functions.
Cell, 7. Januar, 2011
Weitere Informationen erhalten Sie von:
Prof. Dr. F.-Ulrich Hartl
Max-Planck-Institut für Biochemie, Martinsried
E-Mail: uhartl@biochem.mpg.de
Anja Konschak
Max-Planck-Institut für Biochemie, Martinsried
Tel.: +49 89-8578-2824
E-Mail: konschak@biochem.mpg.de
Media Contact
Weitere Informationen:
http://www.mpg.deAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Diamantstaub leuchtet hell in Magnetresonanztomographie
Mögliche Alternative zum weit verbreiteten Kontrastmittel Gadolinium. Eine unerwartete Entdeckung machte eine Wissenschaftlerin des Max-Planck-Instituts für Intelligente Systeme in Stuttgart: Nanometerkleine Diamantpartikel, die eigentlich für einen ganz anderen Zweck bestimmt…

Neue Spule für 7-Tesla MRT | Kopf und Hals gleichzeitig darstellen
Die Magnetresonanztomographie (MRT) ermöglicht detaillierte Einblicke in den Körper. Vor allem die Ultrahochfeld-Bildgebung mit Magnetfeldstärken von 7 Tesla und höher macht feinste anatomische Strukturen und funktionelle Prozesse sichtbar. Doch alleine…

Hybrid-Energiespeichersystem für moderne Energienetze
Projekt HyFlow: Leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem für moderne Energienetze. In drei Jahren Forschungsarbeit hat das Konsortium des EU-Projekts HyFlow ein extrem leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem entwickelt, das einen…





















