Schutz vor schwerer Malaria geklärt
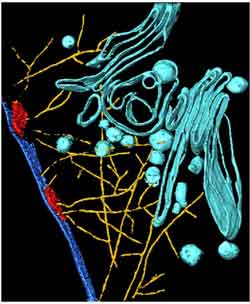
In roten Blutkörperchen mit normalem Hämoglobin baut der Malaria-Erreger Plasmodium falciparum ein Transportsystem (gelb) auf. Darüber gelangen Eiweiße des Parasiten - in Transporthüllen verpackt - (türkis) direkt zur Zelloberfläche des roten Blutkörperchens. Bild: courtesy of Science/AAAS.<br>
Warum bekommen Menschen, die an einer erblichen Veränderung des roten Blutfarbstoffes Hämoglobin leiden, wie bei der in Afrika häufigen Sichelzellanämie, keine schwere Malaria?
Wissenschaftler um Professor Dr. Michael Lanzer vom Department für Infektiologie am Universitätsklinikum Heidelberg haben dieses Rätsel gelöst: Ein Abbauprodukt des veränderten Hämoglobins schützt vor einem schweren Verlauf der Malaria. Innerhalb der vom Malaria-Erreger infizierten roten Blutkörperchen blockiert es den Aufbau eines Transportsystems, über das spezielle Haftproteine des Erregers an die Außenseite der Blutzellen gelangen. So bleiben die befallenen Blutzellen nicht – wie für diese Malariaform typisch – an den Gefäßwänden hängen. Gefährliche Durchblutungsstörungen und neurologische Komplikationen bleiben aus. Die Forschungsarbeit ist – vorab online – im Fachmagazin „Science“ veröffentlicht.
In den 1940er Jahren haben Forscher bereits entdeckt, dass die Sichelzellenanämie mit ihrer charakteristischen Blutveränderung in bestimmten Bevölkerungsgruppen Afrikas besonders häufig vorkam, die außerdem die normalerweise besonders schwer verlaufende „Malaria tropica“ überlebten. Hierbei gelangen die Malaria-Parasiten (Plasmodien) beim Stich infizierter Anopheles-Mücken in den Menschen, wo sie sich zunächst in den Leberzellen vermehren und dann die roten Blutkörperchen (Erythrocyten) befallen. Im Inneren der Erythrocyten teilen sie sich erneut und zerstören diese schließlich. Das nahezu gleichzeitige Aufplatzen aller befallenen Blutzellen verursacht die charakteristischen Beschwerden wie Fieberschübe und Blutarmut.
Haftproteine auf roten Blutkörperchen verursachen Durchblutungsstörungen
Bei der Malaria tropica kommt es zudem häufig zu neurologischen Komplikationen wie Lähmungen, Krämpfen, Koma sowie schweren Gehirnschäden. Grund dafür ist eine Eigenart des Erregers Plasmodium falciparum: Er bildet spezielle Haftproteine, die zur Zelloberfläche der befallenen Blutkörperchen gelangen. Dort sorgen sie dafür, dass die Erythrocyten an Gefäßwänden haften bleiben – sie können damit nicht in der Milz als beschädigt erkannt und aus dem Verkehr gezogen werden. Der Schutzmechanismus des Parasiten hat zur Folge, dass sich kleinere Gefäße verschließen, entzünden und z.B. Teile des Nervensystems nicht mehr ausreichend mit Sauerstoff versorgt werden.
Diese Komplikationen treten bei Menschen mit veränderten Varianten des Hämoglobins abgeschwächt oder gar nicht auf. „Auf der Zelloberfläche befallener Erythrocyten mit verändertem Hämoglobin finden sich deutlich weniger Haftproteine des Parasiten als bei normalen roten Blutkörperchen“, erklärt Professor Lanzer, Direktor des Instituts für Parasitologie. „Wir haben daher den Transportweg innerhalb der Wirtszelle genauer untersucht.“ Das Team verglich dazu Blutzellen mit normalem Hämoglobin und zwei Hämoglobinvarianten (Hämoglobin S und Hämoglobin C), die bei rund einem Fünftel der afrikanischen Bevölkerung in Malaria-Gebieten vorkommen.
Transportsystem des Malaria-Erregers erstmals sichtbar gemacht
Dabei entdeckten die Wissenschaftler mit Hilfe hochauflösender Mikroskopieverfahren wie der Kryo-Elektronentomographie einen neuen Transportmechanismus: Der Parasit verwendet ein bestimmtes Eiweiß (Aktin) aus dem Zellskelett des Erythrocyten für ein eigenes Wegenetz. „Es bildet sich ein vollständig neues Gebilde, das keine Ähnlichkeit mit dem übrigen Zellskelett hat“, erklärt Dr. Marek Cyrklaff, Arbeitsgruppenleiter am Institut für Parasitologie und Erstautor des Artikels. „Über diese Aktinfasern gelangen die Vesikel mit den Haftproteinen vom Parasiten direkt zur Zelloberfläche des roten Blutkörperchens.“
Anders bei Erythrocyten mit den beiden Hämoglobinvarianten: Hier finden sich nur kurze Aktin-Ästchen, ein gezielter Transport zur Oberfläche ist nicht möglich. „Das gesamte Transportsystem des Malaria-Erregers ist in diesen Blutzellen degeneriert“, so Cyrclaff. Labortests ergaben, dass dafür nicht die Hämoglobine selbst, sondern ein Abbauprodukt, das Ferryl-Hämoglobin, verantwortlich ist. Dabei handelt es sich um irreversibel geschädigtes, chemisch verändertes Hämoglobin, das keinen Sauerstoff mehr binden kann. Die Hämoglobine S und C sind deutlich instabiler als normales Hämoglobin; in Blutzellen mit diesen Varianten findet sich daher zehnmal mehr Ferryl-Hämoglobin als in anderen Erythrocyten. Diese hohe Konzentration destabilisiert die Bindungen des Aktingeflechts – es zerfällt.
„Mit Hilfe dieser Ergebnisse haben wir erstmals einen molekularen Mechanismus beschrieben, der die Schutzwirkung dieser Hämoglobinvarianten gegen Malaria erklärt“, sagt Professor Lanzer.
Literatur:
Hemoglobins S and C interfere with Actin Remodeling in Plasmodium falciparum-Infected Erythrocytes: Marek Cyrklaff, Cecilia P. Sanchez, Nicole Kilian, Cyrille Bisseye, Jacques Simpore, Friedrich Frischknecht and Michael Lanzer. Science DOI: 10.1126/science.1213775
Kontakt:
Professor Dr. Michael Lanzer
Direktor des Instituts für Parasitologie
Department für Infektiologie am Universitätsklinikum Heidelberg
Tel.: 06221 / 56 78 45
E-Mail: michael.lanzer@med.uni-heidelberg.de
Universitätsklinikum und Medizinische Fakultät Heidelberg
Krankenversorgung, Forschung und Lehre von internationalem Rang
Das Universitätsklinikum Heidelberg ist eines der größten und renommiertesten medizinischen Zentren in Deutschland; die Medizinische Fakultät der Universität Heidelberg zählt zu den international bedeutsamen biomedizinischen Forschungseinrichtungen in Europa. Gemeinsames Ziel ist die Entwicklung neuer Therapien und ihre rasche Umsetzung für den Patienten. Klinikum und Fakultät beschäftigen rund 10.000 Mitarbeiter und sind aktiv in Ausbildung und Qualifizierung. In mehr als 50 Departments, Kliniken und Fachabteilungen mit ca. 2.000 Betten werden jährlich rund 550.000 Patienten ambulant und stationär behandelt. Derzeit studieren ca. 3.600 angehende Ärzte in Heidelberg; das Heidelberger Curriculum Medicinale (HeiCuMed) steht an der Spitze der medizinischen Ausbildungsgänge in Deutschland.
Bei Rückfragen von Journalisten:
Dr. Annette Tuffs
Presse- und Öffentlichkeitsarbeit des Universitätsklinikums Heidelberg
und der Medizinischen Fakultät der Universität Heidelberg
Im Neuenheimer Feld 672
69120 Heidelberg
Tel.: 06221 / 56 45 36
Fax: 06221 / 56 45 44
E-Mail: annette.tuffs(at)med.uni-heidelberg.de
Media Contact
Weitere Informationen:
http://www.klinikum.uni-heidelberg.deAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Diamantstaub leuchtet hell in Magnetresonanztomographie
Mögliche Alternative zum weit verbreiteten Kontrastmittel Gadolinium. Eine unerwartete Entdeckung machte eine Wissenschaftlerin des Max-Planck-Instituts für Intelligente Systeme in Stuttgart: Nanometerkleine Diamantpartikel, die eigentlich für einen ganz anderen Zweck bestimmt…

Neue Spule für 7-Tesla MRT | Kopf und Hals gleichzeitig darstellen
Die Magnetresonanztomographie (MRT) ermöglicht detaillierte Einblicke in den Körper. Vor allem die Ultrahochfeld-Bildgebung mit Magnetfeldstärken von 7 Tesla und höher macht feinste anatomische Strukturen und funktionelle Prozesse sichtbar. Doch alleine…

Hybrid-Energiespeichersystem für moderne Energienetze
Projekt HyFlow: Leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem für moderne Energienetze. In drei Jahren Forschungsarbeit hat das Konsortium des EU-Projekts HyFlow ein extrem leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem entwickelt, das einen…





















