Protein in Spinnengestalt
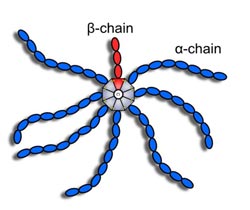
Schematische Darstellung des "Spinnen-Proteins" C4BP. © HZI / Schmelz<br>
Das Protein C4BP ähnelt in seiner räumlichen Gestalt mit acht „Armen“ einer Spinne. Die Struktur des „Spinnenkörpers“ haben Forscher vom Braunschweiger Helmholtz-Zentrum für Infektionsforschung (HZI) und der TU Darmstadt jetzt im Detail aufgeklärt. Diese bringt die Wissenschaftler auf ungewöhnliche Ideen: Das Protein eignet sich möglicherweise als Grundgerüst für den Wirkstofftransport. Ihre Ergebnisse veröffentlichen die Forscher in der aktuellen Ausgabe der internationalen Fachzeitschrift Journal of Molecular Biology.
Das sogenannte Komplementsystem ist Teil der angeborenen Immunabwehr im menschlichen Körper: Über sechzig verschiedene Proteine bilden eine der ersten Gegenmaßnahmen gegen eingedrungene Krankheitserreger. Eines davon ist das C4b-bindende Protein, kurz C4BP. Im Blut ist es an der Immunabwehr gegen Bakterien beteiligt. Wie genau ein solcher Eiweißstoff seine Funktion ausübt oder wie er mit anderen Molekülen in Wechselwirkung tritt, das können die Wissenschaftler nur dann genau vorhersagen, wenn sie die räumliche Struktur des Moleküls kennen. Strukturbiologen untersuchen daher die Substanz in reinster Form mit Röntgengeräten und können dann am Computer den räumlichen Bauplan rekonstruieren. Im Fall des jetzt beschriebenen C4BP fanden sie heraus: Es hat acht „Arme“ und ähnelt damit gewissermaßen einer Spinne. Sieben der „Arme“ sind als „Alpha-Ketten“ identisch, der achte, eine „Beta-Kette“ unterscheidet sich von den übrigen. Der „Spinnenkörper“, der diese Seitenketten zusammenhält, wird Oligomerisierungsdomäne genannt. Dessen Aufbau war für die Forscher von besonderem Interesse, denn er gibt die räumliche Anordnung der „Arme“ vor.
Die jetzt beschriebene Struktur lässt dafür zwei mögliche Varianten zu. „Von diesen beiden Möglichkeiten ist eine aber wahrscheinlicher, weil sie viel stabiler ist“, sagt Thomas Hofmeyer, Doktorand am Institut für Organische Chemie und Biochemie der TU Darmstadt und Erstautor der Publikation. Und stabil ist das C4BP durchaus, wie der zweite Erstautor Dr. Stefan Schmelz aus der Abteilung Molekulare Strukturbiologie des HZI ergänzt: „Es lässt sich nicht einmal durch Kochen aus der Form bringen.“ Normalerweise sind menschliche Proteine etwa bis 40°C stabil. Höhere Temperaturen herrschen zwar im Körper nicht, doch die Haltbarkeit von C4BP hat einen ganz anderen Nutzen: „Wie alle Bestandteile des Komplementsystems kommt auch das C4b-bindende Protein im Blutplasma vor. Im Blutstrom sind die Proteine enormen Scherkräften ausgesetzt“, erklärt Dr. Andrea Scrima, Leiter der Nachwuchsgruppe „Strukturbiologie der Autophagie“ am HZI. Diesen Kräften muss das Protein standhalten können.
Die räumliche Struktur wollen die Forscher sich jetzt zunutze machen. Ihre Kenntnis ermöglicht die biochemische Synthese des Moleküls. Beim Nachbau im Reagenzglas können die Forscher gezielt Veränderungen vornehmen: „Statt der sieben Alpha-Ketten könnten wir andere Biomoleküle einbauen“, so Prof. Harald Kolmar, Leiter der Arbeitsgruppe Angewandte Biochemie am Institut für Organische Chemie und Biochemie an der Technischen Universität Darmstadt. „Wir können die Oligomerisierungsdomäne wie ein Gerüst nutzen, um es mit Wirkstoffmolekülen zu dekorieren.“ Diese könnten zum Beispiel Impfstoffe sein. Sieben auf einen Streich, durch die siebenfache Bindungsmöglichkeit. So gebündelt gelangt mehr Wirkstoff an sein Ziel. Die Dosis könnte reduziert werden und das Immunsystem würde trotzdem stärker stimuliert. „Möglicherweise könnten dadurch Versorgungs-Engpässe bei Impfstoffen in Zukunft vermieden und Nebenwirkungen reduziert werden“, sagt Kolmar.
Originalpublikation:
Thomas Hofmeyer*, Stefan Schmelz*, Matteo T. Degiacomi, Matteo Dal Peraro, Matin Daneschdar, Andrea Scrima, Joop van den Heuvel, Dirk W. Heinz, Harald Kolmar, * geteilte Erstautorenschaft
Arranged Sevenfold: Structural Insights into the C-Terminal Oligomerization Domain of Human C4b-Binding Protein
Journal of Molecular Biology, 2013, DOI: 10.1016/j.jmb.2012.12.017
Das Helmholtz-Zentrum für Infektionsforschung:
Am Helmholtz-Zentrum für Infektionsforschung (HZI) untersuchen Wissenschaftler die Mechanismen von Infektionen und ihrer Abwehr. Was Bakterien oder Viren zu Krankheitserregern macht: Das zu verstehen soll den Schlüssel zur Entwicklung neuer Medikamente und Impfstoffe liefern. http://www.helmholtz-hzi.de
Die Technische Universität Darmstadt:
Die TU Darmstadt zählt zu den führenden Technischen Universitäten in Deutschland. Ihre rund 300 Professorinnen und Professoren, 4.500 wissenschaftliche und administrativ-technische Mitarbeiterinnen und Mitarbeiter, Auszubildende und wissenschaftliche Hilfskräfte sowie 25.000 Studierende widmen sich entscheidenden Zukunftsfeldern wie Energie, Mobilität, Kommunikation und Information sowie Bauen und Wohnen.
http://www.tu-darmstadt.de
Gemeinsame Pressemitteilung des HZI und der TU Darmstadt
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Diamantstaub leuchtet hell in Magnetresonanztomographie
Mögliche Alternative zum weit verbreiteten Kontrastmittel Gadolinium. Eine unerwartete Entdeckung machte eine Wissenschaftlerin des Max-Planck-Instituts für Intelligente Systeme in Stuttgart: Nanometerkleine Diamantpartikel, die eigentlich für einen ganz anderen Zweck bestimmt…

Neue Spule für 7-Tesla MRT | Kopf und Hals gleichzeitig darstellen
Die Magnetresonanztomographie (MRT) ermöglicht detaillierte Einblicke in den Körper. Vor allem die Ultrahochfeld-Bildgebung mit Magnetfeldstärken von 7 Tesla und höher macht feinste anatomische Strukturen und funktionelle Prozesse sichtbar. Doch alleine…

Hybrid-Energiespeichersystem für moderne Energienetze
Projekt HyFlow: Leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem für moderne Energienetze. In drei Jahren Forschungsarbeit hat das Konsortium des EU-Projekts HyFlow ein extrem leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem entwickelt, das einen…





















