Neues Puzzlestück in der Autismus-Forschung

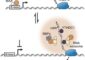
Mutationen des TBR1-Gens beeinflussen die Verteilung des TBR1-Proteins (rot) in menschlichen Zellen. Normalerweise kommt es zusammen mit der DNA (blau) im Zellkern vor (links). Mutiertes TBR1-Protein verteilt sich dagegen an verschiedenen Orten innerhalb Zelle. © MPI f. Psycholinguistik/ Deriziotis
Erkrankungen wie Autismus werden oft durch genetische Mutationen verursacht. Solche Mutationen können die Form von Proteinen verändern und beeinträchtigen dadurch ihre Funktion während der Hirnentwicklung. Die genetische Ursache von Autismus ist jedoch kompliziert, die Erkrankung lässt sich nicht auf nur eine einzige genetische Ursache zurückführen.
Manche Menschen sind durch vererbte genetische Varianten möglicherweise einem höheren Risiko ausgesetzt. Forschungsergebnisse der vergangenen Jahre haben jedoch gezeigt, dass schwere Fälle von Autismus durch neue Mutationen verursacht werden können, die im Spermium oder in der Eizelle auftreten. Diese genetischen Varianten treten im Kind auf, nicht jedoch in dessen Eltern.
Wissenschaftler haben das Erbgut von tausenden nicht miteinander verwandten Kindern mit schwerem Autismus entschlüsselt und herausgefunden, dass eine Handvoll Gene von unabhängigen neuen Mutationen betroffen sein können. Von besonderem Interesse für die Forscher ist hierbei das sogenannte TBR1-Gen, das bei der Hirnentwicklung eine Schlüsselrolle spielt.
Forschern am Max-Planck-Institut für Psycholinguistik in Nijmegen, Niederlande, zufolge führen Mutationen von TBR1 in hochgradig autistischen Kindern dazu, dass das zugehörige Protein nicht mehr richtig funktioniert. Außerdem habe sie einen direkten Zusammenhang zwischen TBR1 und FOXP2 entdeckt, einem Protein das beim Spracherwerb eine große Rolle spielt.
Bei Autismus handelt es sich um eine Entwicklungsstörung des Gehirns, die zu Schwächen in sozialer Interaktion und Kommunikation führt. Während ein Drittel der Betroffenen keine Lautsprache entwickelt, können andere Autisten fließend sprechen, haben jedoch Schwierigkeiten, wenn es darum geht eine Konversation aufrecht zu erhalten oder nicht wörtlich gemeinte Äußerungen korrekt zu interpretieren. Somit kann die Autismus-Forschung uns helfen zu verstehen, welche neuronalen Vernetzungen im Gehirn die soziale Kommunikation steuern, und wie sie sich entwickeln.
In der Studie haben Forscher der Abteilung für Sprache und Genetik am Max-Planck-Institut in Nijmegen zusammen mit Kollegen der University of Washington untersucht, wie sich Mutationen, die das Risiko von Autismus erhöhen, auf die Funktion des TBR1-Proteins auswirken. Das besondere Interesse der Wissenschaftler galt dabei dem direkten Vergleich zwischen den bei Autismus auftretenden neuen und vererbten Mutationen. Nach Aussage der Wissenschaftler verändern die neuen Mutationen die Verteilung von TBR1 in der Zelle.
„Wir stellten fest, dass die neuen Mutationen weitaus dramatischere Auswirkungen auf die Funktion des TBR1-Proteins haben als die vererbten Mutationen“, sagt Erstautorin Pelagia Deriziotis. „Ein klarer Beweis für den starken Einfluss, den sie auf die frühkindliche Hirnentwicklung haben können.“
Die Funktion des Gehirns hängt vom Zusammenspiel verschiedener Gene und Proteine ab. „Man kann das Gehirn als eine Art soziales Netzwerk für Proteine betrachten“, sagt Deriziotis. „Es gab erste Anzeichen dafür, dass TBR1 mit einem Protein namens FOXP2 ‚befreundet‘ sein könnte.
Das ist faszinierend, denn FOXP2 ist eines der wenigen Gene, die eindeutig mit Sprachstörungen in Verbindung gebracht werden.“ Die Forscher haben nicht nur herausgefunden, dass TBR1 direkt mit FOXP2 interagiert, sondern auch, dass diese Interaktion nicht mehr funktioniert, wenn eine dieser beiden Proteine eine Mutation aufweist.
„Das Aufdecken dieser faszinierenden molekularen Verbindungen bei Erkrankungen, die sich auf Erwerb und Verständnis von Sprache auswirken, ist wirklich spannend“, erklärt Simon Fisher, Direktor am Max-Planck-Institut für Psycholinguistik. „Indem wir aus Erbgut-Analysen gewonnene Daten und im Labor durchgeführte funktionale Analysen zusammenführen, zeichnen wir Schritt für Schritt ein Bild der neurogenetischen Bahnen, die zu grundlegenden menschlichen Eigenschaften beitragen.“
Ansprechpartner
Dr. Pelagia Deriziotis
Max-Planck-Institut für Psycholinguistik, Nijmegen
Telefon: +31 62263 4580
Dr. Sarah Graham
Max-Planck-Institut für Psycholinguistik, Nijmegen
Telefon: +31 64843 5419
Media Contact
Weitere Informationen:
http://www.mpg.de/8417096/autismus_tbr1_genAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Neuartiges Material für nachhaltiges Bauen
Innovativer Werkstoff für eine energieeffiziente Architektur: Forschende des Karlsruher Instituts für Technologie (KIT) stellen in der aktuellen Ausgabe der Fachzeitschrift Nature Communications ein polymerbasiertes Material mit besonderen Eigenschaften vor. Das…

Neues Antibiotikum gegen Erreger der Flussblindheit und Lymphatischen Filariose
Prof. Achim Hoerauf, Direktor des Instituts für Medizinische Mikrobiologie, Immunologie und Parasitologie des Universitätsklinikums Bonn (UKB), und seinem Team ist es in Kollaboration mit der Abteilung Pharmazeutische Technologie und Biopharmazie…
Evolutionäre Genomik: Folgen biodiverser Fortpflanzungssysteme
Die Deutsche Forschungsgemeinschaft (DFG) fördert die Einrichtung eines neuen Graduiertenkollegs (GRK) in der Biologie an der Universität Göttingen. Das GRK mit dem Titel „Evolutionary Genomics: Consequences of Biodiverse Reproductive Systems…