Neue Technologie ermöglicht tiefen Blick in Proteinstrukturen
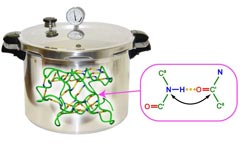
Illustration der Temperatur- und Druckabhängigkeit von Wasserstoffbrücken am Beispiel des Modellproteins Ubiquitin<br>
Mit einem neuartigen Messverfahren, der Kernmagnetresonanz-spektroskopie (NMR) unter hohem Druck, ist es nun Prof. Stephan Grzesiek und Dr. Lydia Nisius vom Biozentrum der Universität Basel gelungen, einen bisher einmaligen Einblick in das Netzwerk von Wasserstoffbrücken und deren Bedeutung für die Proteinstabilität zu gewinnen. Die Ergebnisse sind im renommierten Fachjournal «Nature Chemistry» veröffentlicht.
Proteine bestehen aus einer Abfolge von Aminosäuren und übernehmen wichtige physiologische Funktionen, wie beispielsweise den Transport von Stoffwechselprodukten. Damit die Proteine ihre physiologischen Aufgaben in der Zelle wahrnehmen können, müssen sie durch Faltungen ihrer linearen Aminosäurekette eine stabile dreidimensionale Struktur bilden.
Diese räumliche Anordnung wird unter anderem durch ein Netzwerk aus Wasserstoffbrücken bestimmt. Bisher war allerdings unklar, welche Wasserstoffbrücken genau für die Stabilität der Struktur von Bedeutung sind. Mit einer kürzlich entwickelten NMR-Methode unter Einsatz einer neuen Hochdruckzelle gelang es Prof. Stephan Grzesiek und Dr. Lydia Nisius nun erstmals, die Stabilität von Wasserstoffbrücken des Proteins Ubiquitin vollständig zu charakterisieren.
Stabile Wasserstoffbrücken über weite Distanzen
Die Stabilität von thermodynamischen Systemen, wie es Proteine sind, kann durch Druck- und Temperaturveränderungen analysiert werden. Am Modellprotein Ubiquitin untersuchten die Wissenschaftler wie jede einzelne der 31 Wasserstoffbrücken zur Stabilität der Proteinstruktur beiträgt. Dafür wurde jede Wasserstoffbrücke bei sich ändernden Druck- und Temperaturverhältnissen genau ausgemessen. Durch die neue Druckzelle war es möglich, das Protein im NMR-Gerät einem Druck von bis zu 2‘500 bar auszusetzen. Dies entspricht dem Schweredruck einer Wassersäule von 25 km Höhe. Dabei erwiesen sich Wasserstoffbrücken, die in der Sequenz benachbarte Aminosäuren verbinden, als besonders stabil, während Brücken zu entfernten Aminosäuren generell instabiler waren.
Erstaunlicherweise zeigten sich jedoch Ausnahmen zur Regel: Wasserstoffbrücken, die wichtige Stellen des Ubiquitins miteinander verbinden, können gleichzeitig sehr grosse Entfernungen überspannen und trotzdem extrem stabil sein. Dies betraf vor allem den Teil der Struktur, mit der Ubiquitin an andere Proteine bindet. Ubiquitin ist in der Zelle unter anderem für die Qualitätskontrolle der Proteine zuständig. Indem es sich an fehlerhaft gefaltete Proteine anhängt, markiert es diese für den Abbau. Die spezifische Stabilisierung der Struktur an dieser Bindungsstelle ist demnach sehr wichtig, um die Proteinstruktur unter mechanischem Stress in der Zelle zu bewahren und damit seine korrekte Funktion zu gewährleisten.
Zukunftsweisende Hochdruck-NMR Technologie
Mit der genauen Charakterisierung von Ubiquitin durch Hochdruck-NMR konnten Nisius und Grzesiek nicht nur die hohe thermodynamische Stabilität dieses Proteins erklären, sondern zudem die Teile der Struktur identifizieren, die dafür verantwortlich sind. Die Arbeit gibt Einblicke in die vielseitigen und sich ständig erweiternden Möglichkeiten der NMR-Spektroskopie. Mit dem Einsatz dieser neuartigen Technologie können über die reinen Strukturinformationen hinaus auch Erkenntnisse zu den thermodynamischen Eigenschaften von Biomolekülen und so zum Verständnis ihrer Funktion gewonnen werden.
Originalbeitrag
Lydia Nisius and Stephan Grzesiek
Key stabilizing elements of protein structure identified through pressure and temperature perturbation of its hydrogen bond network.
Nature Chemistry, published online 8 Jul 2012 | doi:10.1038/nchem.1396
Weitere Auskünfte
Prof. Dr. Stephan Grzesiek, Biozentrum der Universität Basel, Strukturbiologie & Biophysik, Klingelbergstrasse 50/70, 4056 Basel, Tel. +41 61 267 21 00, E-Mail: stephan.grzesiek@unibas.ch
Media Contact
Weitere Informationen:
http://www.unibas.ch http://www.nature.com/nchem/journal/vaop/ncurrent/abs/nchem.1396.htmlAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Diamantstaub leuchtet hell in Magnetresonanztomographie
Mögliche Alternative zum weit verbreiteten Kontrastmittel Gadolinium. Eine unerwartete Entdeckung machte eine Wissenschaftlerin des Max-Planck-Instituts für Intelligente Systeme in Stuttgart: Nanometerkleine Diamantpartikel, die eigentlich für einen ganz anderen Zweck bestimmt…

Neue Spule für 7-Tesla MRT | Kopf und Hals gleichzeitig darstellen
Die Magnetresonanztomographie (MRT) ermöglicht detaillierte Einblicke in den Körper. Vor allem die Ultrahochfeld-Bildgebung mit Magnetfeldstärken von 7 Tesla und höher macht feinste anatomische Strukturen und funktionelle Prozesse sichtbar. Doch alleine…

Hybrid-Energiespeichersystem für moderne Energienetze
Projekt HyFlow: Leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem für moderne Energienetze. In drei Jahren Forschungsarbeit hat das Konsortium des EU-Projekts HyFlow ein extrem leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem entwickelt, das einen…





















