Momentaufnahme eines Hepatitis C-Virenangriffs
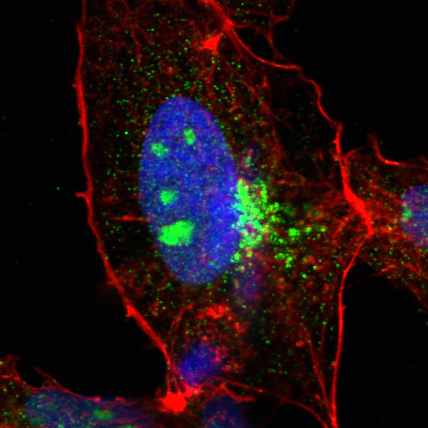
Menschliche Leberzelle mit dem neuen HCV-Wirtsfaktor SRFBP1 (grün). Das SRFBP1-Protein befindet sich im Zytoplasma und im Kern (blau) der Zelle. Rot: Zelluläres Zytoskelett.
Mit dem Hepatitis-C-Virus sind etwa 160 Millionen Menschen infiziert. Zwar stehen der Medizin inzwischen neue Medikamente gegen das Virus zur Verfügung, diese sind jedoch sehr teuer, so dass weiterhin nach neuen – kostengünstigeren – Strategien gegen das Hepatitis-C-Virus gesucht werden muss.
Das Tückische: Es nistet sich chronisch in der Leber ein. Häufig ist die Leber der Patienten 15 bis 25 Jahre nach der Infektion so stark angegriffen, dass den Kranken ein neues Organ transplantiert werden muss. Wissenschaftlern am TWINCORE ist nun eine kleine Revolution in der Erforschung dieses Virus – und womöglich auch anderer Viren – gelungen:
Sie haben eine Methode entwickelt, mit der sie exakt bestimmen können, welche Proteine das Virus innerhalb der Leberzellen während der Infektion missbraucht. So können neue Angriffspunkte gegen das Virus identifiziert – und damit möglicherweise neue Medikamente entwickelt werden.
Der zentrale Zellbaustein, über den sich das Hepatitis-C-Virus in Leberzellen einschleust, ist ein Proteinkomplex, der durch die Membran der Zelle hindurchreicht und zwischen dem Inneren der Zelle und ihrer Außenwelt vermittelt: CD81 ist sozusagen eine zelluläre Sicherheitstür mit Codeschloss.
Dockt sich beispielsweise ein Virus auf der Zellaußenseite an CD81 an, schickt es damit ein Signal – ein molekulares Codewort – in das Zellinnere. Diese Information wird im Inneren der Zelle verarbeitet. Die Zelle verändert den Teil von CD81, der in das Innere der Zelle hineinragt, indem sie hier Moleküle an CD81 anhängt oder abnimmt. Darüber wird der Schließmechanismus der Sicherheitstür gesteuert. HCV kennt den richtigen Code für Leberzellen. Die Tür öffnet sich
Gisa Gerold und ihrem Team aus dem Institut für Experimentelle Virologie des TWINCORE gelingt es nun mit ihrer neuen Methode, sozusagen Momentaufnahmen des gesamten CD81 Komplexes zu machen. „Wir können den Komplex mitsamt den Proteinen, die daran binden, isolieren und so vergleichen, welche Proteine mit und ohne Virus an CD81 aktiv sind“, erklärt die Wissenschaftlerin.
„Das Besondere an der neue Methode ist, dass wir frei untersuchen können, was für molekulare Interaktionen es bei der Infektion gibt – wir müssen keine Annahmen treffen, welche Moleküle wir suchen müssen, sondern finden unvoreingenommen alle Proteine, die zu einem bestimmten Zeitpunkt mit CD81 interagieren.“
Auf diese Weise hat sie 26 Proteine gefunden, die beim Einschleusungsprozess von HCV in die Leberzelle mit CD81 in Wechselwirkung treten – sechs von ihnen unterstützen die HCV-Infektion. Eins von den sechs Molekülen spielt eine zentrale Rolle beim Eintritt des Virus in Leberzellen: das „serum response factor binding protein 1“, kurz SRFBP1.
„Diese Methode werden wir zu einem Hochdurchsatzverfahren in Standardlaborformaten weiterentwickeln, so dass wir auch von anderen Viren, erfahren, wie sie mit der Zelle interagieren. Zu lernen, wie sich Viren Zugang zu Zellen verschaffen, ist essenziell, um Strategien gegen Virusinfektionen entwickeln zu können“, ist die Wissenschaftlerin überzeugt.
Die wichtige Frage: Wird es möglich sein, über die nun identifizierten, HCV-einschleusenden Moleküle ein neues Medikament gegen das Virus zu entwickeln? Das wird die künftige Forschung zeigen. Ein Wirkstoff, der verhindert, dass das Hepatitis-C-Virus Leberzellen neu infiziert, ist bei der Therapie der chronischen HCV -Infektion nicht nützlich. „Aber um zu verhindern, dass sich eine gesunde, frisch transplantierte Leber wieder schnell durch Viren aus dem Blutkreislauf des Patienten reinfiziert, wäre ein solcher Wirkstoff sehr wertvoll“, sagt Gisa Gerold.
Literatur:
Gerold G, Meissner F, Bruening J, Welsch K, Perin PM, Thomas F. Baumert, Vondran FW, Kaderali L, Marcotrigiano J, Khan AG, Mann M, Rice CM*, Pietschmann T*. (2015) Quantitative Proteomics Identifies Serum Response Factor Binding Protein 1 as a Host Factor for Hepatitis C Virus Entry. Cell Reports. 2015 Jul 22. pii: S2211-1247(15)00689-0. doi: 10.1016/j.celrep.2015.06.063.
Weblink:
http://dx.doi.org/10.1016/j.celrep.2015.06.063
Ansprechpartnerin:
Dr. Gisa Gerold, gisa.gerold(at)twincore.de
Tel.: +49 (0)511-220027-134
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Diamantstaub leuchtet hell in Magnetresonanztomographie
Mögliche Alternative zum weit verbreiteten Kontrastmittel Gadolinium. Eine unerwartete Entdeckung machte eine Wissenschaftlerin des Max-Planck-Instituts für Intelligente Systeme in Stuttgart: Nanometerkleine Diamantpartikel, die eigentlich für einen ganz anderen Zweck bestimmt…

Neue Spule für 7-Tesla MRT | Kopf und Hals gleichzeitig darstellen
Die Magnetresonanztomographie (MRT) ermöglicht detaillierte Einblicke in den Körper. Vor allem die Ultrahochfeld-Bildgebung mit Magnetfeldstärken von 7 Tesla und höher macht feinste anatomische Strukturen und funktionelle Prozesse sichtbar. Doch alleine…

Hybrid-Energiespeichersystem für moderne Energienetze
Projekt HyFlow: Leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem für moderne Energienetze. In drei Jahren Forschungsarbeit hat das Konsortium des EU-Projekts HyFlow ein extrem leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem entwickelt, das einen…





















