Lassen sich Alterungs- und Stoffwechselprozesse steuern? Neues zur Aktivierung von Sirtuinen
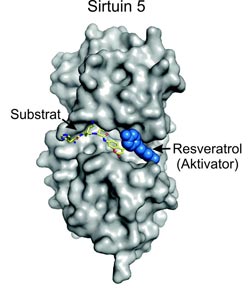
Die Grafik zeigt einen Komplex, der zusammen mit Sirt5 ein mit Fluorophor versehenes Peptid als Substrat und das Resveratrol als Aktivator enthält.<br><br>Grafik: Lehrstuhl für Biochemie, Universität Bayreuth; mit Quellennachweis zur Veröffentlichung frei.<br>
Diesem Fernziel ist die biochemische Grundlagenforschung einen bedeutenden Schritt nähergekommen. Eine Forschungsgruppe unter der Leitung von Prof. Dr. Clemens Steegborn an der Universität Bayreuth hat jetzt in der Online-Ausgabe des Wissenschaftsmagazins „PLOS ONE“ neue Ergebnisse veröffentlicht, die für weitere Forschungen richtungsweisend sind.
Sirtuine: Impulsgeber für zelluläre Prozesse
Stoffwechsel- und Alterungsprozesse zu steuern, ist eine Kernfunktion von Sirtuinen, einer besonderen Klasse von Enzymen. Im Organismus des Menschen gibt es sieben verschiedene Sirtuine, die in der Forschung als „Sirt1“ bis „Sirt7“ bezeichnet werden. Sie verändern die Strukturen lebenswichtiger Proteine in der Weise, dass sie an ausgewählten Stellen dieser Moleküle Acetylgruppen abspalten. Von diesem Vorgang, der Deacetylierung, gehen entscheidende Signale für zelluläre Prozesse aus, beispielsweise für die Erzeugung neuer Proteine auf Basis genetischer Informationen oder die Anpassung des Nährstoffabbaus. Die medizinische und die pharmazeutische Forschung haben deshalb ein wachsendes Interesse an der Funktionsweise von Sirtuinen und ihrer Beeinflussung durch pharmakologische Wirkstoffe.
Die Kausalzusammenhänge zwischen Sirtuinen und zellulären Prozessen liegen noch weitgehend im Dunkeln. Zu ihrer Aufklärung hat ein Forschungsteam um Dr. Melanie Gertz und Prof. Dr. Clemens Steegborn an der Universität Bayreuth – in Kooperation mit Wissenschaftlern der Ruhr-Universität Bochum und der Universität Wien – jetzt einen entscheidenden Beitrag leisten können.
Verstärkende und schwächende Wirkungen von Resveratrol
Im Mittelpunkt der in „PLOS ONE“ präsentierten Forschungsarbeiten steht Resveratrol, eine natürliche Substanz, die beispielsweise in Trauben und auch im Rotwein in höherer Konzentration enthalten ist. Die Wissenschaftler haben nachweisen können, dass Resveratrol einerseits die deacetylierende Wirkung von Sirt5 auf Peptide und Proteine verstärken kann, andererseits die deacetylierende Wirkung von Sirt3 unterdrückt. Dabei haben sie eine Hypothese entkräftet, die aufgrund bisheriger Forschungsarbeiten nahelag: nämlich die Vermutung, Resveratrol könne Sirtuine nur dann in dieser Weise beeinflussen, wenn die Peptide künstlich mit fluoreszierenden Molekülen – sogenannten Fluorophoren – gekoppelt worden sind. Wie die jetzt veröffentlichten Forschungsergebnisse zeigen, ist dieser Einfluss des Resveratrol unabhängig von einer derartigen Modifikation.
Die Wirksamkeit des Enzyms Sirt5 wird künstlich gesteigert
In einem weiteren Schritt haben die Forscher diese Wirkungen genauer analysiert. Mit proteinkristallographischen Verfahren haben sie die dreidimensionale Struktur eines Komplexes sichtbar gemacht, der zusammen mit Sirt5 ein mit Fluorophor versehenes Peptid als Substrat und das Resveratrol als Aktivator enthält. Substrat und Aktivator befinden sich hier in unmittelbarer Nähe zueinander. Für die deacetylierende Wirkung des Sirtuins auf das Peptid erweist sich diese Dreiecksbeziehung als außerordentlich vorteilhaft.
Damit die deacetylierende Wirkung des Enzyms Sirt5 zustande kommt, muss es das Peptid in die eigene molekulare Struktur – genauer gesagt: in die sogenannte Peptid-Bindungstasche – aufnehmen. Von entscheidender Bedeutung ist dabei eine geeignete räumliche Ausrichtung des Peptids. Nachdem sich das Peptid in die offene Bindungstasche eingefügt hat, kommt das Resveratrol hinzu und nistet sich ebenfalls dort ein. Es schließt diese offene Flanke im Sirt5-Molekül, so dass das Peptid gleichsam darin gefangen ist. Zugleich tritt das Resveratrol in eine enge Wechselwirkung mit dem Peptid ein. So entsteht eine Konstellation, welche die deacetylierende Wirkung des Sirtuins steigert. Denn wie es scheint, hindert das Resveratrol das Peptid daran, vor seiner Deacetylierung durch Sirt5 die Bindetasche zu verlassen; zudem sorgt es für eine räumliche Ausrichtung des Peptids, die für die Deacetylierung besonders günstig ist.
Die Wechselwirkung, welche die Forscher zwischen dem Resveratrol und dem mit Fluorophor ausgestatteten Peptid entdeckt haben, ist genauso möglich, wenn das Substrat nicht in gleicher Weise künstlich verändert wurde. Dies erklärt die beobachtete Aktivierung von Sirt5 in Bezug auf natürliche Peptide, wie sie in Lebewesen vorkommen.
Ein vergleichbarer Mechanismus schwächt die Wirksamkeit des Enzyms Sirt3
In analoger Weise haben die Biochemiker in Bayreuth untersucht, wie Resveratrol und verwandte Substanzen die deacetylierende Wirkung von Sirt3 beeinflussen. In der dreidimensionalen Struktur, in der Sirt3 an die Stelle von Sirt5 tritt, ist es jetzt Piceatannol, ein mit Resveratrol nahezu identisches Kleinmolekül, das an das Sirtuin andockt. Das Piceatannol – wie zuvor das Resveratrol – geht eine direkte Wechselwirkung mit dem Peptid ein. Doch der deacetylierende Einfluss des Sirtuins wird jetzt nicht gesteigert, sondern im Gegenteil unterdrückt.
Was ist die Ursache dafür, dass Resveratrol / Piceatannol auf Sirt5 und Sirt3 diese gegensätzlichen Effekte haben? Auf eine endgültige Antwort wollen sich die Forscher noch nicht festlegen, doch eine erste Spur haben sie gefunden. Die Wechselwirkungen, die das Resveratrol / Piceatannol einerseits mit dem Sirtuin und andererseits mit dem Peptid unterhält, führen dazu, dass das Peptid in Sirt3 eine etwas andere räumliche Ausrichtung einnimmt als in Sirt5. Für den Prozess der Deacetylierung ist diese Positionierung des Substrats von entscheidender Bedeutung. Schon eine geringe Änderung kann daher zu der Verlangsamung bei Sirt3 führen, aber auch zu der Beschleunigung bei Sirt5.
Die Wirkung von Resveratrol auf das Sirtuin hängt vom Substrat ab
Das Forschungsteam in Bayreuth hat noch eine weitere aufschlussreiche Beobachtung gemacht: Weil das Peptid in seiner Rolle als Substrat direkt mit dem Aktivator interagiert, lag die Vermutung nahe, dass die Art des Peptidsubstrats einen Einfluss darauf hat, wie diese Substanzen die deacetylierende Wirkung des Sirtuins verändern. Einen derartigen Einfluss konnten die Wissenschaftler für Sirt5 tatsächlich in ersten Experimenten nachweisen. In weiteren Untersuchungen will die Gruppe um Prof. Dr. Clemens Steegborn diesen Mechanismus weiter überprüfen und genauer charakterisieren.
Ein Strukturmodell für die weitere Forschung:
Auf dem Weg zu einer gezielten Steuerung
Mit den jetzt in „PLOS ONE“ präsentierten Forschungsergebnissen liegt erstmals ein Strukturmodell vor, das es erlaubt, die Wirkungen von Resveratrol und ähnlichen Substanzen auf Sirt3 und Sirt5 – aber auch auf andere Sirtuine wie das viel untersuchte Sirt1 – grundsätzlich zu verstehen und systematisch weiter zu analysieren. Die Autoren sehen in diesem Modell einen Wegweiser für die nächsten Forschungsarbeiten. „Insbesondere sollten wir jetzt verschiedene Peptide und Proteine daraufhin untersuchen, wie ihre Deacetylierung durch Sirtuine gefördert oder behindert wird, wenn Resveratrol und ähnliche Substanzen auf die Sirtuine einwirken“, erklärt Steegborn, und er fügt hinzu: „Aufgrund der bisherigen Forschungsarbeiten zeichnet sich jetzt eine hochinteressante Forschungsperspektive ab: nämlich die Entwicklung von Aktivatoren oder Inhibitoren, die geradezu maßgeschneidert sind, um die Wirkungen von Sirt3 und Sirt5 nur auf einzelne, ausgewählte Proteine zu regulieren. Damit lassen sich spezifischere Wirkungen erzielen, als wenn man die Deacetylierung aller Substratproteine gleichermaßen verändern würde. Auch unerwünschte Nebenwirkungen können dadurch vermieden werden. Der Vision, Alterungs- oder Stoffwechselprozesse durch pharmazeutische Substanzen zielgenau steuern zu können, würden wir damit einen bedeutenden Schritt näher kommen.“
Veröffentlichung:
Melanie Gertz et al.,
A Molecular Mechanism for Direct Sirtuin Activation by Resveratrol,
in: PLOS ONE (2012), published online first on November 21, 2012
DOI: 10.1371/journal.pone.0049761
Ansprechpartner:
Prof. Dr. Clemens Steegborn
Lehrstuhl für Biochemie
Universität Bayreuth
D-95440 Bayreuth
Telefon: +49 (0)921 55 2421
E-Mail: clemens.steegborn@uni-bayreuth.de
Media Contact
Weitere Informationen:
http://www.uni-bayreuth.deAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Diamantstaub leuchtet hell in Magnetresonanztomographie
Mögliche Alternative zum weit verbreiteten Kontrastmittel Gadolinium. Eine unerwartete Entdeckung machte eine Wissenschaftlerin des Max-Planck-Instituts für Intelligente Systeme in Stuttgart: Nanometerkleine Diamantpartikel, die eigentlich für einen ganz anderen Zweck bestimmt…

Neue Spule für 7-Tesla MRT | Kopf und Hals gleichzeitig darstellen
Die Magnetresonanztomographie (MRT) ermöglicht detaillierte Einblicke in den Körper. Vor allem die Ultrahochfeld-Bildgebung mit Magnetfeldstärken von 7 Tesla und höher macht feinste anatomische Strukturen und funktionelle Prozesse sichtbar. Doch alleine…

Hybrid-Energiespeichersystem für moderne Energienetze
Projekt HyFlow: Leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem für moderne Energienetze. In drei Jahren Forschungsarbeit hat das Konsortium des EU-Projekts HyFlow ein extrem leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem entwickelt, das einen…





















