Wie ein Kraftwerk gebaut wird – Energieversorgung in Zellen
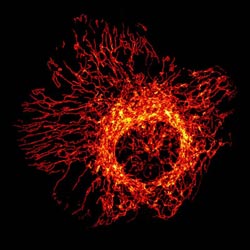
Mitochondrien-Netzwerk in einer menschlichen Zelle. Immunfluoreszenz-mikroskopische Aufnahme.<br>Aufnahme: in Zusammenarbeit mit Prof. Dr. Stefan Jakobs, Max-Planck-Institut für biophysikalische Chemie, Abteilung für NanoBiophotonik, Göttingen/umg, Prof. Dr. Peter Rehling<br>
Schon ein kleiner Störfall in den Energie-Kraftwerken unserer Zellen, den Mitochondrien, macht krank. Jeder Defekt, der die Ausbildung eines reibungslosen Betriebsablaufs stört, führt zu schweren, häufig tödlichen Herz- und Nervenerkrankungen beim Menschen. Doch bisher fehlt in vielen Fällen das Wissen darüber, was genau die Ursache dafür ist.
Grundlagenforscher der Universitätsmedizin Göttingen konnten jetzt einen entscheidenden Schritt im komplizierten Betriebsablauf der zellulären Kraftwerke klären. Das Team um den Biochemiker Prof. Dr. Peter Rehling, Direktor der Abteilung Biochemie II an der Universitätsmedizin Göttingen, hat einen bisher nicht bekannten Proteinkomplex in der Membran der Mitochondrien identifiziert. Damit ist es jetzt zum ersten Mal möglich, Vorgänge zu verstehen, die für den Aufbau funktioneller Atmungskettenkomplexe in den Kraftwerken der Zellen bedeutsam sind. Die Ergebnisse aus der Grundlagenforschung wurden am 21. Dezember 2012 in der renommierten Fachzeitschrift „CELL“ veröffentlicht.
ORIGINALPUBLIKATION: MITRAC Links Mitochondrial Protein Translocation to Respiratory-Chain Assembly and Translational Regulation. David U. Mick, Sven Dennerlein, Heike Wiese, Robert Reinhold, David Pacheu-Grau, Isotta Lorenzi, Florin Sasarman, Woranontee Weraarpachai, Eric A. Shoubridge, Bettina Warscheid, and Peter Rehling Cell 151
„Es ist ein zentrales Anliegen unserer Arbeitsgruppe, die Prozesse zu verstehen, wie die Kraftwerke in unseren Zellen und besonders die Atmungskette zusammengebaut werden. Unser Ziel ist es, die Grundlagen für mitochondriale Erkrankungen untersuchen zu können“, sagt Prof. Dr. Peter Rehling, Senior-Autor der Publikation. Seine Forschergruppe „Mitochondrien-Biogenese und Assemblierung von Membranprotein-Komplexen“ arbeitet dabei eng mit dem Max-Planck-Institut für biophysikalische Chemie in Göttingen zusammen. In der aktuellen Publikation sind die Forscher intensiv der Frage nachgegangen, wie die Atmungskettenkomplexe zusammengesetzt werden. Dazu müssen Proteine, die in Mitochondrien hergestellt werden, und Proteine, die von außen importiert werden, zusammengebracht wer-den. Wie geschieht dies? Dieses Phänomen ist seit langem unverstanden.
Bekannt ist: Die Mitochondrien stammen in ihrer evolutionären Herkunft von Bakterien ab. Den Großteil ihrer genetischen Informationen haben sie im Laufe von Millionen Jahren an den Zellkern verloren. Die meisten Proteine, die in unseren Kraftwerken ihren Dienst tun, müssen daher in die Mitochondrien hinein transportiert werden. Aber Mitochondrien besitzen auch noch eigenes Erbmaterial. Sie sind in der Lage, einen sehr kleinen Satz von 13 essentiellen Proteinen selbst zu synthetisieren. Diese Proteine sind die Kernproteine der Atmungskettenkomplexe.
ERGEBNIS: PROTEINKOMPLEX „MITRAC“ HILFT BEIM ZUSAMMENBAU
Wie nun genau passiert der notwendige Zusammenbau von eigenen und externen Proteinen in den Mitochondrien? Dies konnten Prof. Rehling und sein Forscherteam für den Komplex IV, einen von insgesamt vier Funktionsmodulen der Atmungskette klären: Der neuentdeckte Proteinkomplex „MITRAC“ erfüllt die zentrale Funktion beim Zusammenbau des Komplexes IV der Atmungskette. Die Forscher konnten zeigen, dass an dieser Stelle importierte Proteine und Proteine, die in den Mitochondrien selbst gebildet werden, zusammengeführt werden. Gleichzeitig regulieren Proteinbestandteile des MITRAC-Komplexes die Neusynthese von Proteinen in den Mitochondrien. Diese Kopplung schützt die Mitochondrien davor, mehr Proteine zu bilden als sie brauchen. Als Bestandteile des MITRAC-Komplexes konnten sie zudem mehrere Proteine identifizieren, die ursächlich für schwere Erkrankungen des Menschen verantwortlich gemacht werden. Die Untersuchung der Arbeitsgruppe weist diesen Proteinen nun erstmalig eine klare Funktion in der Biogenese der Atmungskette zu – und zwar genau im Komplex IV. Die Ergebnisse der Forscher beantworten zentrale Fragen der Grundlagenforschung, die seit vielen Jahren unverstanden sind, und liefern damit wichtige neue Erkenntnisse für das Verständnis von schweren Erkrankungen des Herz- und Nervensystems. „In der Zukunft“, so Prof. Rehling, „werden wir nun weiter der Frage nachgehen, wie der Zusammenbau von kern- und mitochondrial kodierten Proteinen in einen funktionellen Atmunskettenkomplex IV reguliert wird. Und wir hoffen unsere Erkenntnisse auch auf weitere Komplexe der Atmungskette ausdehnen zu können.“
Mitochondrien – wie die Kraftwerke in unseren Zellen funktionieren
In allen unseren Zellen zahlen wir für Arbeit, die geleistet wird, mit einer allgemein-gültigen Energiewährung: ATP, kurz für „Adenosintriphosphat“. Hergestellt wird dieser universelle Energieträger ATP in den Kraftwerken unserer Zellen, den Mitochondrien. Die Energie aus der Nahrung wird in den Mitochondrien dazu benutzt, wie bei einer Batterie ein elektrochemisches Potential über einer Membran zu erzeugen. Dieses Spannungspotential treibt einen Proteinkomplex an, der das ATP für die Zelle herstellt. Zur Erzeugung des elektrochemischen Gradienten sind Multiproteinkomplexe in der inneren Membran der Mitochondrien zuständig. Sie transportieren Elektronen, die aus der Nahrung stammen und übertragen diese schließlich auf Sauerstoff. Bei diesem Prozess werden 95 Prozent des Sauerstoffs, den wir täglich einatmen, verbraucht. Daher werden die insgesamt vier Proteinkomplexe, die bei der ATP-Gewinnung beteiligt sind, als „Atmungskette“ bezeichnet. Der letzte und vierte Komplex der Atmungskette ist derjenige, der aus Sauerstoff Wasser bildet.
WEITERE INFORMATIONEN
Universitätsmedizin Göttingen – Georg-August-Universität
Abteilung Biochemie II
Herzzentrum Universitätsmedizin Göttingen
Forschungsgruppe „Mitochondrien-Biogenese und Assemblierung von Membranprotein-Komplexen“ – assoziiert mit MPI für biophysikalische Chemie
Prof. Dr. Peter Rehling, Telefon 0551 / 39-5947
Humboldtallee 23, 37073 Göttingen
Peter.Rehling@medizin.uni-goettingen.de
http://www.mpibpc.mpg.de/33380/rehling
Media Contact
Weitere Informationen:
http://www.medizin.uni-goettingen.deAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Diamantstaub leuchtet hell in Magnetresonanztomographie
Mögliche Alternative zum weit verbreiteten Kontrastmittel Gadolinium. Eine unerwartete Entdeckung machte eine Wissenschaftlerin des Max-Planck-Instituts für Intelligente Systeme in Stuttgart: Nanometerkleine Diamantpartikel, die eigentlich für einen ganz anderen Zweck bestimmt…

Neue Spule für 7-Tesla MRT | Kopf und Hals gleichzeitig darstellen
Die Magnetresonanztomographie (MRT) ermöglicht detaillierte Einblicke in den Körper. Vor allem die Ultrahochfeld-Bildgebung mit Magnetfeldstärken von 7 Tesla und höher macht feinste anatomische Strukturen und funktionelle Prozesse sichtbar. Doch alleine…

Hybrid-Energiespeichersystem für moderne Energienetze
Projekt HyFlow: Leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem für moderne Energienetze. In drei Jahren Forschungsarbeit hat das Konsortium des EU-Projekts HyFlow ein extrem leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem entwickelt, das einen…





















