Frachthafen Zelle: Freiburger Wissenschaftler filmen Stofftransport in lebenden Zellen und finden neue Sortierstation für Proteine
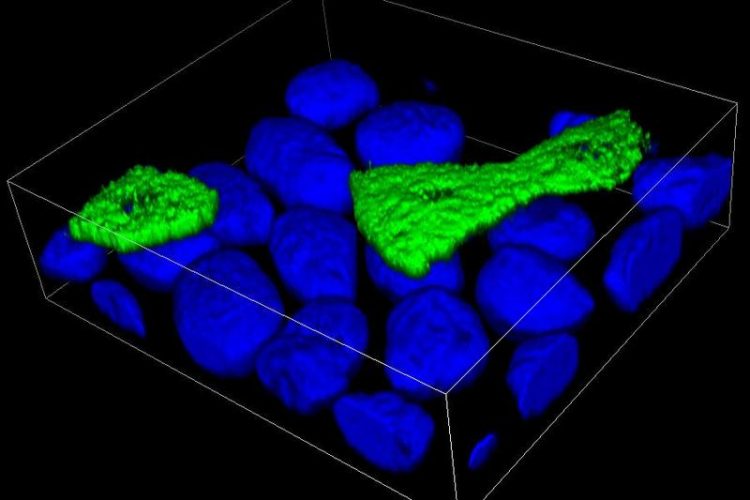
3D-Darstellung von polarisierten Epithelzellen, bei denen die Zellkerne blau angefärbt sind. Einige Zellen enhalten ein fluoreszierendes Protein (grün) in der apikalen Zellmembran.
Der Freiburger Biophysiker Dr. Roland Thünauer und Juniorprofessor Dr. Winfried Römer, Institut für Biologie II und Mitglied des Exzellenzclusters BIOSS Centre for Biological Signalling Studies der Universität Freiburg, haben einen neuen Mechanismus entdeckt, über den Proteine zur Außenmembran von Epithelzellen transportiert werden.
Diese weisen eine Polarität auf: Die nach außen gerichtete, apikal genannte Seite der Zelle ist mit anderen Proteinen ausgestattet als die basale, dem Organinneren zugewandte Seite. Wie die Proteine zu der ihnen zugewiesenen Zellseite über kleine Membran-Container – so genannte Vesikel – gelangen, ist nicht vollständig bekannt.
Die Zellen des Epithels ähneln einem Frachthafen: Stoffe werden angeliefert, verladen, produziert und versendet. Einblicke in die Organisation des „Frachthafens Zelle“ können dabei helfen, Erkrankungen zu behandeln, bei denen dieser Transport gestört ist.
Mithilfe von Live-Mikroskopie und dem zeitlich abgestimmten Transport fluoreszierender Proteine in lebenden Zellen haben Thünauer und Römer den Weg eines Proteins von der Produktion bis zur Ankunft an der apikalen Zellmembran aufgezeichnet.
In Zusammenarbeit mit Forscherinnen und Forschern vom Weill Cornell Medical College in New York/USA und der CBL GmbH in Linz/Österreich deckten sie neue Mechanismen und Signalproteine auf, die Stoffe zur apikalen Membran sortieren und transportieren. Die Studie ist in der Fachzeitschrift „Proceedings of the National Academy of Sciences“ (PNAS) erschienen.
Im endoplasmatischen Retikulum werden Zellmembranproteine neu hergestellt. Anschließend werden sie in einer Zwischenstation, dem so genannten Golgi-Apparat, verladen und über weitere kleinere Vesikel an die benötigte Stelle in der Zelle oder der Zellmembran verfrachtet.
Die Forscher entdeckten, dass Proteine, die zur apikalen Membran verladen werden sollen nachdem diese den Golgi-Apparat verlassen, auch an einer weiteren Zwischenstation sortiert werden: „apical recycling endosomes“ (ARE). Daran ist insbesondere das Protein Rab11 beteiligt. Nach dem Verlassen der ARE werden die apikalen Proteine wiederum in Vesikel verpackt und an die Zielmembran gesendet. Auch bei der letzten Station spielt das Protein Rab11 eine wichtige Rolle: Die Vesikel verbinden sich mit der Außenmembran. So gelangen die Proteine zur apikalen Zelloberfläche.
Originalveröffentlichung:
Roland Thuenauer, Ya-Chu Hsu, Jose Maria Carvajal-Gonzalez, Sylvie Deborde, Jen-Zen Chuang, Winfried Römer, Alois Sonnleitner, Enrique Rodriguez-Boulan, and Ching-Hwa Sung Four-dimensional live imaging of apical biosynthetic trafficking reveals a post-Golgi sorting role of apical endosomal intermediates doi: 10.1073/pnas.130416811
Kontakt:
Juniorprofessor Dr. Winfried Römer
BIOSS Centre for Biological Signalling Studies
Albert-Ludwigs-Universität Freiburg
Tel.: 0761/203-67500
E-Mail: winfried.roemer@bioss.uni-freiburg.de
Media Contact
Weitere Informationen:
http://www.uni-freiburg.deAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Diamantstaub leuchtet hell in Magnetresonanztomographie
Mögliche Alternative zum weit verbreiteten Kontrastmittel Gadolinium. Eine unerwartete Entdeckung machte eine Wissenschaftlerin des Max-Planck-Instituts für Intelligente Systeme in Stuttgart: Nanometerkleine Diamantpartikel, die eigentlich für einen ganz anderen Zweck bestimmt…

Neue Spule für 7-Tesla MRT | Kopf und Hals gleichzeitig darstellen
Die Magnetresonanztomographie (MRT) ermöglicht detaillierte Einblicke in den Körper. Vor allem die Ultrahochfeld-Bildgebung mit Magnetfeldstärken von 7 Tesla und höher macht feinste anatomische Strukturen und funktionelle Prozesse sichtbar. Doch alleine…

Hybrid-Energiespeichersystem für moderne Energienetze
Projekt HyFlow: Leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem für moderne Energienetze. In drei Jahren Forschungsarbeit hat das Konsortium des EU-Projekts HyFlow ein extrem leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem entwickelt, das einen…





















