Ein Faktor reicht – selbst beim Menschen

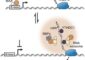
Zellen der glatten Muskulatur: Menschliche iPS Zellen, die mittels eines Faktors (Oct4) aus neuronalen Stammzellen entstanden, wurden zu Zellen der glatten Muskulatur differenziert. Die rote Fluoreszenz zeigt einen spezifischen Marker für glatte Muskulatur, die Zellkerne sind blaufluoreszierend angefärbt. Bild: Max-Planck-Institut für molekulare Biomedizin/Kinarm Ko
Wissenschaftlern des Max-Planck-Instituts (MPI) für molekulare Biomedizin in Münster ist es gelungen, erstmals adulte menschliche Zellen mit einem einzigen eingeschleusten Gen in induzierte pluripotente Stammzellen (iPS) zu verwandeln. Das Team um Hans Schöler konnte nachweisen, dass der Faktor Oct4 auch beim Homo sapiens ausreicht, um bestimmte Körperzellen in ähnlich wandlungsfähige Multitalente zu verwandeln wie es embryonale Stammzellen sind. Das macht die Zellen sicherer für künftige Therapien. Der jüngste Erfolg unterstreicht, dass die iPS-Technologie gerade für Deutschland eine einzigartige Chance bietet, zu einem „Key Player“ auf dem Gebiet der Stammzellforschung zu werden. (Online-Vorabpublikation Nature, 28. August 2009)
Bisher waren die Aussichten dafür eher schlecht. Denn anders als in den USA, Australien, Israel oder Großbritannien sind Stammzellforschern in Deutschland in vielen Fällen die Hände gebunden: Die Gewinnung menschlicher embryonaler Stammzellen (ES-Zellen) ist gesetzlich verboten. Auch die Einfuhr und Verwendung solcher Zellen aus dem Ausland ist nur in wenigen Ausnahmen, nach sorgfältiger Prüfung und unter strengen gesetzlichen Auflagen erlaubt.
Induzierte pluripotente Stammzellen dagegen sind ethisch und juristisch unbedenklich. Auch deutsche Wissenschaftler und Mediziner können daher ohne Einschränkungen mit diesen Zellen forschen. Zudem macht die Reprogrammierung ausgereifter Zellen in pluripotente ‚Alleskönner’ derzeit rasante Fortschritte: Vor gerade einmal drei Jahren war es japanischen Forscher erstmals geglückt, ausgereifte Hautzellen einer Maus mithilfe von vier Transkriptionsfaktoren namens Oct4, Sox2, Klf4 und c-Myc so umzuprogrammieren, dass sie sich wie embryonale Stammzellen verhalten und wie diese jeden der mehr als 200 Zelltypen des Körpers bilden können. Nicht einmal ein Jahr später zeigte sich, dass die gleiche Methode auch bei menschlichen Hautzellen funktioniert. Der Haken daran war nur: Viele der Versuchstiere, denen man iPS-Zellen implantiert hatte, erkrankten wenige Wochen später an Krebs.
Kurz darauf fanden die Zellbiologen Jeong Beom Kim und Holm Zaehres aus Schölers Team in Untersuchungen an Mäusen heraus, dass neurale Stammzellen aus dem Gehirn von Natur aus erhöhte Mengen der Produkte von Sox2 und c-Myc bilden. Statt einem „Cocktail“ aus vier, berichteten die Forscher Mitte 2008 in Nature, reichen auch zwei Faktoren, um die Lebensuhr in diesen Zellen zurückzudrehen.
Anfang 2009 hatten Kim und Zaehres die Technik erneut vereinfacht. Wie sie herausfanden, genügt ein einziges Gen aus dem Cocktail, um die Lebensuhr in neuralen Stammzellen von Mäusen zurückzudrehen: der Transkriptionsfaktor Oct4. Jetzt glückte Jeong Beom Kim und seinen Kollegen der technisch noch schwierigere Schritt: Mithilfe eines Retrovirus schleusten sie das Oct4-Gen in menschliche neurale Stammzellen, die seit Jahren als Zell-Linie gezüchtet werden. Aus den Kulturen isolierten die Forscher dann jene Zellen, die sich in iPS verwandelt hatten. Eine Leistung, die nicht nur Geduld, sondern auch Geschick erfordert. Denn sowohl neurale als auch pluripotente Stammzellen des Menschen teilen sich wesentlich langsamer als solche von Mäusen. Zudem neigen menschliche pluripotente Stammzellen – und zwar sowohl ES als auch iPS – dazu, sich zu spezialisieren und damit ihre Pluripotenz zu verlieren.
Der jüngste Erfolg der Münsteraner Forscher ist gleich in mehrfacher Hinsicht ein wichtiger Fortschritt für eine künftige klinische Nutzung pluripotenter Stammzellen. Schon heute sind zwar menschliche iPS verfügbar, die von Hautzellen, so genannten Fibroblasten abstammen und für die Erforschung von Krankheitsmechanismen und für die Suche nach Therapien für bislang unheilbare Krankheiten genutzt werden. Doch die bisher verfügbaren Zell-Linien haben mehrere Nachteile. Zum einen wurden für ihre Reprogrammierung noch mehrere Gene mithilfe von Viren in die Zellen eingeschleust. Dabei gilt: Je mehr eingeschleuste Gene und Viren, desto größer das Risiko die Entwicklung von Tumoren. Mit nur einem eingeschleusten Gen sind die jetzt von Kim und seinen Kollegen gezüchteten menschlichen iPS also deutlich sicherer.
Zum anderen hat sich inzwischen gezeigt: Je ähnlicher die Ausgangszellen dem Gewebe sind, für das sie später als Ersatzzellen genutzt werden sollen, desto besser. Denn: Alle Körperzellen häufen im Laufe des Lebens Schäden in ihrem Erbgut an. Am größten aber sind diese Schäden an jenen Genen, die von den Zellen am wenigsten genutzt werden. Das heißt: Für Hautleiden sind solche iPS besser geeignet, die aus Fibroblasten gewonnen wurden. Um Nervenerkrankungen zu behandeln, sollten dagegen am besten iPS verwendet werden, die von Nervenzellen abstammen.
Neben solchen Stammzelltherapien eröffnet die erfolgreiche Züchtung menschlicher iPS jedoch noch weitere viel versprechende Aussichten für die medizinische Forschung. Gelingt es nämlich, verschiedene Zellen aus dem menschlichen Körper erfolgreich zu reprogrammieren, im Reagenzglas zu vermehren und später daraus jeden beliebigen Typ von Körperzelle zu züchten, könnte dies die Erforschung von Krankheiten erheblich erleichtern. Denn an krankheitsspezifischen Zell-Linien könnten Forschern das komplexe Zusammenspiel von Genen und Proteinen bei der Entstehung vieler Krankheiten gezielter untersuchen als bisher. Zudem könnte eine Vielzahl von potentiellen Medikamenten direkt an den kranken Zellen auf ihre Wirkung getestet werden.
Um die iPS-Technologie weiter verfeinern zu können, braucht es allerdings noch einiges an Forschung – und die dafür nötigen Gelder und Strukturen. Das Innovationsministerium des Landes Nordrhein-Westfalen, die Max-Planck-Gesellschaft und die Medizinische Fakultät der Universität Münster haben die Weichen dafür bereits richtig gestellt: Ab dem Frühjahr 2010 werden sich dort vier Nachwuchsgruppen gezielt der Entwicklung von krankheits-spezifischen Modellen widmen.
Originalveröffentlichung:
Jeong Beom Kim, Boris Greber, Marcos J. Araúzo-Bravo, Johann Meyer, Kook In Park, Holm Zaehres und Hans R. Schöler
Direct reprogramming of human neural stem cells by OCT4
Nature, 28. August 2009, doi:10.1038/nature08436
Weitere Informationen erhalten Sie von:
Dr. Jeanine Müller-Keuker, PR-Referentin
Max-Planck-Institut für molekulare Biomedizin, Münster
Tel.: +49 251 70365-325
E-Mail: presse@mpi-muenster.mpg.de
Media Contact
Weitere Informationen:
http://www.mpg.deAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Neuartiges Material für nachhaltiges Bauen
Innovativer Werkstoff für eine energieeffiziente Architektur: Forschende des Karlsruher Instituts für Technologie (KIT) stellen in der aktuellen Ausgabe der Fachzeitschrift Nature Communications ein polymerbasiertes Material mit besonderen Eigenschaften vor. Das…

Neues Antibiotikum gegen Erreger der Flussblindheit und Lymphatischen Filariose
Prof. Achim Hoerauf, Direktor des Instituts für Medizinische Mikrobiologie, Immunologie und Parasitologie des Universitätsklinikums Bonn (UKB), und seinem Team ist es in Kollaboration mit der Abteilung Pharmazeutische Technologie und Biopharmazie…
Evolutionäre Genomik: Folgen biodiverser Fortpflanzungssysteme
Die Deutsche Forschungsgemeinschaft (DFG) fördert die Einrichtung eines neuen Graduiertenkollegs (GRK) in der Biologie an der Universität Göttingen. Das GRK mit dem Titel „Evolutionary Genomics: Consequences of Biodiverse Reproductive Systems…