Wenn die Datenleitung in die Zelle versagt
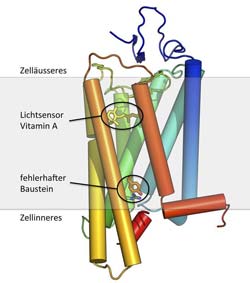
Struktur eines Lichtrezeptors – blockiert im aktiven Zustand. Das Vitamin-A-Molekül funktioniert als Sensor für das ankommende Licht. Unten ist der Baustein markiert, der für die Blockade des Rezeptors verantwortlich ist. In hellgrau ist die Zellmembran angedeutet. Grafik: Paul Scherrer Institut/J. Standfuss<br>
Lebende Zellen empfangen dauernd Informationen von aussen, die über Rezeptoren in das Zellinnere weitergeleitet werden. Genetisch bedingte Fehler in solchen Rezeptoren sind der Grund für zahlreiche Erbkrankheiten, darunter verschiedene hormonelle Funktionsstörungen oder Nachtblindheit.
Bei einem solchen Fehler bleibt der Rezeptor im „eingeschalteten“ Zustand hängen, als wäre er dauerhaft dem äusseren Reiz ausgesetzt. Schliesslich wird er ausser Betrieb gesetzt. Forschern des Paul Scherrer Instituts ist es nun gelungen, die exakte Struktur eines im aktiven Zustand blockierten Rezeptors aufzuklären.
Eine lebende Zelle muss dauernd auf Informationen reagieren, die von aussen bei ihr ankommen. Dafür zuständig, die Information ins Innere weiterzuleiten, sind Rezeptoren, komplexe Proteinmoleküle, die in der Zellmembran sitzen. „Man kann diese Rezeptoren mit einer Türklingel vergleichen. Wenn jemand an der Tür klingelt, kann er im Haus Aktivität auslösen, ohne selbst hineinzugehen“, erklärt Xavier Deupi, Forscher am Paul Scherrer Institut. „Genauso löst ein Rezeptor chemische Vorgänge in der Zelle aus, wenn von aussen ein Reiz bei ihm ankommt. Das kann Licht sein oder auch ein Hormonmolekül, das selbst nicht in die Zelle eindringt.“ Es gibt rund achthundert solcher Rezeptoren, die für verschiedenste Reize zuständig sind.
Die kaputte Türklingel der Zelle
Die Rezeptoren kann man sich als winzige, sehr exakte biologische Maschinen vorstellen, die schon bei kleinsten Abweichungen vom Bauplan nicht richtig funktionieren. Nun ist es einer Gruppe um Jörg Standfuss am Paul Scherrer Institut gelungen, die Struktur eines mutierten und damit fehlerhaften Rezeptors zu bestimmen und so die Grundlage eines solchen Fehlers zu entschlüsseln. „Der untersuchte Rezeptor zeigte einen recht typischen Fehler – er blockiert im aktiven Zustand. Um im Bild der Klingel zu bleiben: Es gibt einen passiven Zustand, in dem die Klingel für Besucher bereit ist, und den aktiven, in dem sie tatsächlich gedrückt wird und läutet“, hält Standfuss fest. „Wenn sie aber weiterläutet, obwohl niemand mehr drückt, ist sie nicht nur nutzlos, sondern auch lästig, sodass man sie in der Regel ausser Betrieb nehmen wird.“ Das Gleiche kann in der Zelle passieren – ein Rezeptor bleibt im aktiven Zustand hängen und täuscht ein Signal vor. Schliesslich blockiert die Zelle den Rezeptor und setzt ihn so ausser Betrieb. „Das ist für die Zelle in mehrfacher Weise belastend. Zum einen fehlt der funktionelle Rezeptor und wichtige Signalwege werden damit blockiert. Zusätzlich können sich kaputte Rezeptoren aber auch bis zu einem Punkt anreichern, an dem sie giftig werden und so zum Tod der Zelle führen“, so Standfuss.
Ein falscher Buchstabe
Das untersuchte Protein verhakt sich gewissermassen in der aktiven Form und findet nicht mehr in die passive zurück. Dabei ist der Unterschied zwischen der „gesunden“ und der mutierten Form scheinbar gering: eine einzige falsche Aminosäure, also ein falscher Proteinbaustein. Im Erbgut entspricht das einem einzigen Basenpaar, gewissermassen einem einzigen Buchstaben in einer langen Bauanleitung. Dieser kleine Fehler führt aber dazu, dass ein Bauteil falsch geformt ist und die ganze Maschine nicht mehr funktioniert. Mithilfe von Untersuchungen an der Synchrotron Lichtquelle Schweiz des Paul Scherrer Instituts ist es den Forschern nun gelungen, den genauen Aufbau des fehlerhaften Teils zu bestimmen und so zu zeigen, wie der Fehler zustande kommt. Diese Versuche wurden an einem künstlich veränderten Protein durchgeführt, an dem sich die Prinzipien besonders gut sichtbar machen lassen.
Die untersuchten Rezeptoren gehören zur Klasse der G-Protein-gekoppelten Rezeptoren. Sie sind in die Zellmembran eingebaut und können so Informationen von aussen nach innen weiterleiten. Der Teil ausserhalb der Zelle ist jeweils für einen spezifischen Reiz empfänglich – etwa Licht oder die Ankunft eines Hormonmoleküls. Kommt ein solcher Reiz an, verändert sich die Struktur des gesamten Moleküls, sodass sich in dem Teil, der ins Zellinnere ragt, ein Freiraum bildet. In diesem Freiraum kann dann ein sogenanntes G-Protein andocken. Der Rezeptor spaltet das G-Protein in zwei Teile auf und lässt diese in die Zellflüssigkeit frei, wo sie einen bestimmten Vorgang in der Zelle auslösen. Im Normalfall formt sich der Rezeptor nach kurzer Zeit wieder zurück und ist bereit für den nächsten Reiz. Ein fehlerhafter Rezeptor hingegen verbleibt in der geöffneten Form, sodass sich immer wieder neue G-Proteine binden können. Schliesslich wird aber stattdessen ein „Arrestin“ genanntes Protein angekoppelt, das den Rezeptor blockiert und so ausser Betrieb setzt.
Krankheiten verstehen
Zahlreiche Erbkrankheiten werden durch solche kleinen Fehler im Aufbau von Rezeptoren verursacht, die wiederum auf Fehler im Erbgut zurückgehen. So ist ein wichtiges langfristiges Ziel der Forschungsarbeiten, die Veränderungen zu verstehen, die hinter verschiedenen Krankheiten stecken und damit die Voraussetzung für die Entwicklung von Therapien zu schaffen. „Am Paul Scherrer Institut betreiben wir Grundlagenforschung – wir wollen die Mechanismen hinter den Erkrankungen verstehen. Die Entwicklung der Medikamente und die klinischen Studien führt die pharmazeutische Industrie durch. Wenn es darum geht, die grundlegenden relevanten Fragen zu identifizieren arbeiten wir eng zusammen“, betont Standfuss.
Text: Paul Piwnicki
Über das PSI
Das Paul Scherrer Institut entwickelt, baut und betreibt grosse und komplexe Forschungsanlagen und stellt sie der nationalen und internationalen Forschungsgemeinde zur Verfügung. Eigene Forschungsschwerpunkte sind Materie und Material, Mensch und Gesundheit, sowie Energie und Umwelt. Mit 1400 Mitarbeitenden und einem Jahresbudget von rund 300 Mio. CHF ist es das grösste Forschungsinstitut der Schweiz.
Kontakt:
Dr. Jörg Standfuss, Labor für Biomolekulare Forschung, Paul Scherrer Institut, 5232 Villigen PSI, Schweiz,
Telefon: +41(0)56 310 2586, E-Mail: joerg.standfuss@psi.ch [Deutsch, Englisch]
Dr. Xavier Deupi, Labor für Biomolekulare Forschung, Paul Scherrer Institut, 5232 Villigen PSI, Schweiz,
Telefon: +41(0)56 310 3337, E-Mail: xavier.deupi@psi.ch [Englisch, Spanisch, Katalanisch]
Originalveröffentlichung:
Stabilized G protein binding site in the structure of constitutively active metarhodopsin-II; Xavier Deupi, Patricia Edwards, Ankita Singhal, Benjamin Nickle, Daniel Oprian, Gebhard Schertler, and Jörg Standfuss; PNAS Early Edition week of December 19, 2011; DOI : http://dx.doi.org/10.1073/pnas.1114089108
Media Contact
Weitere Informationen:
http://www.psi.chAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Diamantstaub leuchtet hell in Magnetresonanztomographie
Mögliche Alternative zum weit verbreiteten Kontrastmittel Gadolinium. Eine unerwartete Entdeckung machte eine Wissenschaftlerin des Max-Planck-Instituts für Intelligente Systeme in Stuttgart: Nanometerkleine Diamantpartikel, die eigentlich für einen ganz anderen Zweck bestimmt…

Neue Spule für 7-Tesla MRT | Kopf und Hals gleichzeitig darstellen
Die Magnetresonanztomographie (MRT) ermöglicht detaillierte Einblicke in den Körper. Vor allem die Ultrahochfeld-Bildgebung mit Magnetfeldstärken von 7 Tesla und höher macht feinste anatomische Strukturen und funktionelle Prozesse sichtbar. Doch alleine…

Hybrid-Energiespeichersystem für moderne Energienetze
Projekt HyFlow: Leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem für moderne Energienetze. In drei Jahren Forschungsarbeit hat das Konsortium des EU-Projekts HyFlow ein extrem leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem entwickelt, das einen…





















