Seltene Kinderkrankheit führt zum Verständnis einer neuartigen Enzymfamilie
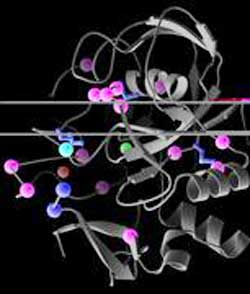
Molekulare Basis der MSD: Die Struktur des FGE-Enzyms ist als Bänderdiagramm in grau dargestellt. Krankheitsverursachende Mutationen, die bislang in MSD-Patienten gefunden wurden, sind als farbige Kugeln hervorgehoben. Die Farbe gibt an, ob die jeweilige Mutation zur Destabilisierung der Struktur (rosa), zur Hemmung der Sulfatase-Bindung (blau) oder zur Blockierung der Enzymaktivität (türkis) führen.
Bielefelder Biochemiker und seine Kooperationspartner entschlüsseln Struktur und Funktionsweise eines medizinisch wichtigen und wissenschaftlich interessanten Enzyms
Wissenschaftler aus der Arbeitsgruppe von Prof. Dr. Thomas Dierks, der 2004 aus Göttingen auf den Lehrstuhl für Biochemie I der Universität Bielefeld berufen wurde, und aus der Abteilung Strukturbiologie der Universität Göttingen haben einen weiteren wichtigen Schritt zum Verständnis der Multiplen Sulfatasedefizienz (MSD) getan. MSD ist eine seltene, stets tödlich verlaufende Erbkrankheit bei Kindern, die dadurch gekennzeichnet ist, dass alle Sulfatasen des Menschen inaktiv sind. Unter „Sulfatasen“ versteht man eine spezielle Gruppe von 16 Enzymen, die dafür sorgen, dass in den menschlichen Zellen Schwefelsäure-Gruppen bei einer Vielzahl von Molekülen abgespalten werden – Voraussetzung für die korrekte Entwicklung und das Funktionieren vieler Organsysteme, darunter auch des Nervensystems. Vor zwei Jahren hatten Dierks und seine Gruppe in der Abteilung des jetzigen Göttinger Universitätspräsidenten Prof. Dr. Kurt von Figura das Gen entdeckt, dessen Defekt die fatale Krankheit verursacht. Die Sequenz dieses Gens verriet jedoch nicht die Funktionsweise des von dem Gen verschlüsselten Enzyms, das die Wissenschaftler Formylglycin-generierendes Enzym (FGE) nannten. FGE war der erste biochemisch beschriebene Vertreter einer neuartigen und doch schon in Bakterien vorhandenen Enzymfamilie, wies aber keine Verwandtschaft zu Enzymen auf, deren Funktion bereits bekannt war.
Durch gentechnologische Produktion konnte die gleiche Arbeitsgruppe nun genügend FGE herstellen, so dass Dr. Markus Rudolph Kristalle dieses Enzyms züchten konnte. Dies ermöglichte letztlich die Aufklärung der räumlichen Struktur von FGE, welche jetzt in der neuesten Ausgabe der international renommierten Zeitschrift „CELL“ (Band 121, Heft 4) veröffentlich wird. Diese Struktur in atomarer Auflösung erlaubte es, die in den MSD-Patienten gefundenen genetischen Veränderungen als Ursache für die Krankheit zu verstehen. Darüber hinaus gab die Struktur aber auch direkte Hinweise auf den Funktionsmechanismus dieses ungewöhnlichen Enzyms, welches eine einzigartige, bislang nur in den Sulfatasen nachgewiesene Aminosäure, das Formylglycin, erzeugt. Vor zehn Jahren hatten die Wissenschaftler diese neue Aminosäure entdeckt und gezeigt, dass Formylglycin für die Funktion der Sulfatasen essentiell ist. FGE kontrolliert somit über die Formylglycin-Bildung die Aktivität der Sulfatase-Enyzme. Dies macht man sich mittlerweile auch in einem biotechnologischen Verfahren zunutze, in dem FGE eingesetzt wird, um bestimmte Sulfatasen effizient herzustellen, die zur Therapie einzelner Sulfatasedefizienz-Erkrankungen angewandt werden.
So ungewöhnlich wie die neuartige Aminosäure Formylglycin in den Sulfatasen, so ungewöhnlich ist auch die jetzt ermittelte Struktur des Formylglycin-erzeugenden Enyzms, das auf den ersten Blick ziemlich „unregelmäßig“ aussieht. Ganz offensichtlich braucht FGE für seine Funktion eine besondere Struktur. Außerdem ergaben sich klare Hinweise auf eine wiederum ungewöhnliche Aminosäure, diesmal im FGE, welche eine neuartige Oxidationsreaktion unter Nutzung von molekularem Sauerstoff zu vermitteln scheint. Auch wenn diese Erkenntnisse erst noch bestätigt werden müssen, so ist jetzt schon klar, dass die FGE-Enzyme Sauerstoff auf erstaunlich einfache, bislang kaum für möglich gehaltene Weise nutzen können, nämlich ohne Beteiligung von Metallen oder anderen kompliziert aufgebauten Faktoren. Hier wollen die Forscher weiter in bewährter Kooperation ihre unterschiedlichen Methoden interdisziplinär einsetzen, um letztlich die genaue Funktionsweise dieser ungewöhnlichen Enzymfamilie aufzuklären.
Kontakt: Prof. Dr. Thomas Dierks, Universität Bielefeld, Fakultät für Chemie, Biochemie I, Tel. 0521/106-2080 oder -6918 (Sekretariat), E-Mail: thomas.dierks@uni-bielefeld.de
Media Contact
Weitere Informationen:
http://www.uni-bielefeld.de/Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Diamantstaub leuchtet hell in Magnetresonanztomographie
Mögliche Alternative zum weit verbreiteten Kontrastmittel Gadolinium. Eine unerwartete Entdeckung machte eine Wissenschaftlerin des Max-Planck-Instituts für Intelligente Systeme in Stuttgart: Nanometerkleine Diamantpartikel, die eigentlich für einen ganz anderen Zweck bestimmt…

Neue Spule für 7-Tesla MRT | Kopf und Hals gleichzeitig darstellen
Die Magnetresonanztomographie (MRT) ermöglicht detaillierte Einblicke in den Körper. Vor allem die Ultrahochfeld-Bildgebung mit Magnetfeldstärken von 7 Tesla und höher macht feinste anatomische Strukturen und funktionelle Prozesse sichtbar. Doch alleine…

Hybrid-Energiespeichersystem für moderne Energienetze
Projekt HyFlow: Leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem für moderne Energienetze. In drei Jahren Forschungsarbeit hat das Konsortium des EU-Projekts HyFlow ein extrem leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem entwickelt, das einen…





















