RUB-Forscher belegen Wechselwirkungen von Eiweißen und Wasser

Forschern der Ruhr-Universität Bochum und der Universität Dortmund um Prof. Dr. Dominik Marx (Lehrstuhl für Theoretische Chemie der RUB) ist es gelungen, die Veränderung der Wasserschicht in Proteinnähe anhand einer kurzen synthetischen Eiweißkette (Peptid) sehr detailliert zu untersuchen. Fazit: Wasser ist nicht, wie bisher üblicherweise angenommen, nur Statist, sondern tritt ins Rampenlicht der Reaktion. Sein dynamisches, temperaturabhängiges Verhalten bestimmt die Proteineigenschaften maßgeblich mit. Über ihre Ergebnisse berichten die Forscher im Fachmagazin „Physical Review Letters“.
Wenn wir ein Ei kochen, spielt das Wasser nicht nur um das Ei herum, sondern auch in den winzigen Strukturen des Eiweißes eine große Rolle: Forschern der Ruhr-Universität Bochum und der Universität Dortmund um Prof. Dr. Dominik Marx (Lehrstuhl für Theoretische Chemie der RUB) ist es nun gelungen, die Veränderung der Wasserschicht in Proteinnähe anhand einer kurzen synthetischen Eiweißkette (Peptid) sehr detailliert zu untersuchen. Fazit: Wasser ist nicht, wie bisher üblicherweise angenommen, nur Statist, sondern tritt ins Rampenlicht der Reaktion. Sein dynamisches, temperaturabhängiges Verhalten bestimmt die Proteineigenschaften maßgeblich mit. Über ihre Ergebnisse berichten die Forscher im Fachmagazin „Physical Review Letters“.
Wasser greift aktiv in Funktion von Biomolekülen ein
Proteine (Eiweiße) sind lange Kettenmoleküle, die aus Aminosäuren in wohldefinierter Abfolge aufgebaut sind. Erhitzt man sie oder kühlt sie ab, gehen die für biologische Funktionen wichtigen Eigenschaften des nativen, gefalteten Zustands verloren („Denaturierung“). Normalerweise ist in der Umgebung von Proteinen immer auch Wasser zu finden, das aber traditionell als unbeteiligtes Lösungsmittel betrachtet wurde. Im Laufe der Zeit haben sich jedoch die Hinweise gemehrt, dass Wasser aktiv in solche Prozesse eingreift: „Die Eigenschaften von Wasser scheinen eine bestimmende Rolle bei der Funktion von Biomolekülen zu spielen“, so Prof. Marx. „Allerdings ist es schwierig, solche Effekte anhand komplexer Biomoleküle, wie sie in der Natur vorkommen, wissenschaftlich fundiert zu untersuchen.“ Erfolgversprechender ist das Studium von synthetischen Biomimetika, also viel einfacherer Substanzen, die den natürlich vorkommenden Molekülen nachempfunden sind und diesen in den entscheidenden Eigenschaften gleichen.
Kleines Modellmolekül untersucht
Ein solches, nur acht Bausteine umfassendes Molekül ist das Oktapeptid GVG(VPGVG). Es ist aus nur drei verschiedenen Aminosäuren (Glycin, Valin und Prolin) aufgebaut und dient als „verkleinertes“ Modell für das Bindegewebsprotein Elastin. An diesem Modell konnten die Forscher mit molekulardynamischen Simulationen zeigen, dass sich die Dynamik der Wassermoleküle in unmittelbarer Nähe des Proteins bei Temperaturänderung charakteristisch verändert. Diese Veränderungen konnten sie wiederum mit Strukturänderungen des Modellproteins korrelieren. „Das gelang uns nur dank der engen Zusammenarbeit von Theoretikern und Experimentatoren in der DFG-Forschergruppe ’Wasser’ (FOR 436)“, unterstreicht Prof. Marx.
Die Rolle des Grenzflächenwassers
Das kurze Modell-Peptid liegt bei ca. 50 Grad Celsius in einem maximal kompakten Zustand vor („gefaltete Konformation“) und streckt sich („entfaltete Konformation“) bei Temperatursteigerung und -senkung. Daher konnten die Forscher beide Prozesse im Temperaturbereich des flüssigen Wassers untersuchen. Sie zeigten, dass die temperaturabhängigen Strukturänderungen des Peptids sich in den Wechselwirkungen zum Wasser widerspiegeln. Insbesondere die Wasserstoffbrückenbindungen zwischen Wassermolekülen und dem Proteinrückgrat („backbone“) lassen sich im Faltungsbereich bis zu ca. 50 Grad Celsius deutlich schwerer brechen als solche zwischen Wassermolekülen in reinem Wasser („bulk“). Dies ändert sich jedoch abrupt bei ca. 50 Grad Celsius: Bei der Entfaltung brechen die Wasserstoffbrücken mit geringerem Energieaufwand als in reinem Wasser, sie sind also gegenüber diesen geschwächt. Damit haben die Forscher erstmals die Änderung des dynamischen Verhaltens des „Grenzflächenwassers“ bei Faltung und Entfaltung eines kurzen Peptids nachgewiesen. Zur Zeit untersuchen sie, ob dies ein Spezifikum kurzer Peptide, oder auch für langkettigere Proteine charakteristisch ist.
Titelaufnahme
E. Schreiner, C. Nicolini, B. Ludolph, R. Ravindra, N. Otte, A. Kohlmeyer, R. Rousseau, R. Winter, and D. Marx: Folding and Unfolding of an Elastinlike Oligopeptide: „Inverse Temperature Transition,“ Reentrance, and Hydrogen-Bond Dynamics. In: Physical Review Letters, Band 92, Nr. 14, S. 148101 (2004).
Weiterführende Literatur
Siehe auch R. Rousseau, E. Schreiner, A. Kohlmeyer, and D. Marx: Temperature-Dependent Conformational Transitions and Hydrogen-Bond Dynamics of the Elastin-Like Octapeptide GVG(VPGVG): a Molecular-Dynamics Study. In: Biophysical Journal, Band 86, S. 1393 (2004).
Siehe auch den populärwissenschaftlichen Artikel H. Weingärtner und D. Marx: Wasser – mehr als ein Lösungsmittel: Das Eis ist heiß. In ChemieRUBIN – Das Wissenschaftsmagazin der RUB (2003), S. 22.
Weitere Informationen
Prof. Dr. Dominik Marx, Lehrstuhl für Theoretische Chemie, Fakultät für Chemie der Ruhr-Universität Bochum, 44780 Bochum, Tel. 0234/32-28083, Fax: 0234/32-14045, E-Mail: dominik.marx@theochem.rub.de
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge
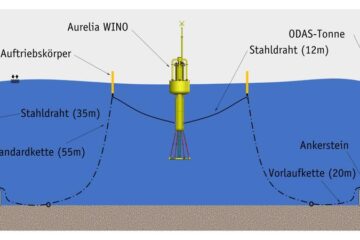
Transport- und Installationskonzept für schwimmendes Wellenkraftwerk
Vor einem Jahr taufte die FH Kiel ihren Prototyp eines schwimmenden Wellenkraftwerks. Jetzt entsteht in Zusammenarbeit mit Industriepartnern ein Transport- und Installationskonzept mit folgendem Szenario: ZUnächst müsste das Wellenkraftwerk aus…

Regenerativer Ackerbau fördert Resilienz von Böden im Klimawandel
Seit Sommer 2020 untersuchen Forschende unter Leitung der Universität Kassel im Projekt AKHWA, ob der Regenerative Ackerbau eine geeignete Strategie ist, um die Landwirtschaft an den Klimawandel anzupassen. Ein zentrales…

Molekulare Dynamik in Echtzeit
Ein europäisches Forschungsteam hat ein neuartiges spektroskopisches Verfahren entwickelt, mit dem sich ultraschnelle dynamische Prozesse von Elektronen und Schwingungen innerhalb von Molekülen verfolgen lassen – und zwar mit atomarer Auflösung…