Neues Licht auf die molekularen Ursachen von Multipler Sklerose
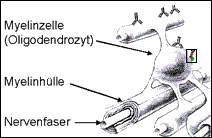
Schematische Darstellung eines Teils einer Nervenzelle mit Myelinhülle und gebundenen Antikörpern an das MOG-Protein. <br>Foto: Max-Planck-Institut für Biochemie
Max-Planck-Forscher entdecken in einem an Multipler Sklerose beteiligten Protein eine „fremde“ Struktur, die vom Immunsystem attackiert wird
Die dreidimensionale Struktur eines Proteins, das bei Multipler Sklerose (MS) eine bedeutende Rolle im Krankheitsverlauf spielt, haben Wissenschaftler der Max-Planck-Institute für Biochemie und Neurobiologie in Martinsried gemeinsam mit Forschern der Technischen Universität München aufgeklärt. Die Einblicke in die atomare Struktur des MOG-Proteins ermöglichen ein besseres Verständnis der Autoimmunreaktion, die als eine der Ursachen für MS angesehen wird (PNAS, vol. 100, no. 16, 5. August 2003).
Wissenschaftler der Abteilung Neuroimmunologie des Max-Planck-Instituts für Neurobiologie erforschen speziell die Reaktionen des Immunsystems, die bei Multipler Sklerose eine wichtige Rolle spielen. Normalerweise verteidigt das Immunsystem den Körper mit speziell ausgerüsteten Zellen gegen Krankheitserreger Bakterien oder Viren und fremde Stoffe (Immunreaktion). Doch bei Fehlern im Immunsystem können sich diese Abwehrstrategien auch gegen körpereigene Komponenten richten und dadurch Autoimmunkrankheiten auslösen. Bei der Multiplen Sklerose binden im Laufe der Krankheit spezifische Antikörper an körpereigene Proteine, die in die Myelinhülle von Nervenfasern eingebettet sind, die daraufhin von bestimmten Zellen des Immunsystems abgebaut wird. Eines dieser Proteine ist MOG (myelin oligodendrocyte glycoprotein). Es kommt nur im Zentralen Nervensystem vor und sitzt dort ganz außen auf der Myelinhülle der Nervenfasern, so dass es von Antikörpern leicht erreicht werden kann (vgl. Abbildung).
Im Rahmen ihrer Doktorarbeit ist es Constanze Breithaupt aus der Abteilung Strukturforschung des Max-Planck-Instituts für Biochemie mit ihren Kollegen gelungen, das Myelinprotein MOG zu kristallisieren und seine dreidimensionale Struktur zu entschlüsseln. Zudem klärten die Forscher auch die gemeinsame Struktur von MOG mit dem MOG-spezifischen Teil des Antikörpers 8-18C5 auf. Die Forscher hatten diesen Antikörper ausgewählt, weil im Tiermodell bereits gezeigt werden konnte, dass seine Bindung an MOG für die Zerstörung des Myelins mit verantwortlich ist. In der dreidimensionalen Struktur der MOG-Antikörper-Verbindung lässt sich erkennen, dass der 8-18C5-Antikörper an den gut zugänglichen Teil von MOG bindet, woran viele Bereiche des Proteins beteiligt sind. Hierbei entdeckten die Wissenschaftler eine schleifenförmige Struktur in dem MOG-Protein, einen so genannten FG-Loop, der aus acht Bausteinen (Aminosäuren) des Proteins besteht und zu dieser Bindung einen besonders großen Beitrag leistet.
Die Entdeckung des FG-Loops bestätigte die bereits früher aufgestellte Hypothese, dass das Immunsystem bestimmte Bereiche von MOG als „fremd“ erkennt und deshalb nicht toleriert. Die Zellen des Immunsystems werden noch im unreifen Zustand mit allen körpereigenen Molekülen konfrontiert. Bindet eine Zelle in diesem Stadium fest an einen körpereigenen Bestandteil, wird sie sofort unschädlich gemacht, bevor sie eine Autoimmunreaktion auslösen kann. Auf diese Weise bleiben nur jene Zellen erhalten, die fremde Moleküle angreifen und die eigenen akzeptieren also so genannte selbsttolerante Zellen. Deshalb werden Proteine, die in ihrer Struktur MOG ähneln, vom Immunsystem nicht angegriffen, wenn sie den unreifen Zellen des Immunsystems „präsentiert“ wurden vielmehr wird jeder noch so kleine Bereich von ihnen als körpereigen akzeptiert.
Doch das MOG-Protein befindet sich hinter der Blut-Hirnschranke auf den Nervenzellen im Zentralen Nervensystem und wird deshalb von den heranreifenden Zellen des Immunsystems nie gesehen. Weist das Protein also nur einen einzigen Teilbereich auf, den seine Verwandten außerhalb des Zentralen Nervensystems nicht haben, kann dieser von eindringenden reaktiven Zellen des Immunsystems als fremd deklariert und eine Immunreaktion ausgelöst werden. Der von den Wissenschaftlern gefundene FG-Loop von MOG, dessen Zusammensetzung sonst in keinem anderen Protein des menschlichen Organismus vorkommt, ist ein Beispiel für einen Protein-Bereich, gegen den der Körper keine Selbsttoleranz entwickelt hat, und der daher durch eine Autoimmunreaktion angegriffen werden kann.
Als die Max-Planck-Wissenschaftler die Aminosäuren-Abfolge dieser seltenen Struktur in eine Protein-Datenbank eingaben, fanden sie dort nur ein einziges Protein mit einem identischen Bereich. Interessanterweise kommt es in Chlamydia-Bakterien vor, deren mögliche Beteiligung an Multipler Sklerose schon länger diskutiert wird. Ob über das MOG-Protein ein Zusammenhang zwischen einer Clamydien-Infektion und später auftretender Multipler Sklerose besteht, ist jetzt Gegenstand weiterer Untersuchungen.
Die Kenntnis der molekularen Struktur von MOG hilft jetzt dabei zu klären, worin die natürliche Funktion von MOG besteht und wie es zu einer pathogenen Antikörper-Antwort gegen MOG bei Multipler Sklerose kommen kann. Anhand der dreidimensionalen Struktur des Proteins und natürlicher Antikörper als Vorlage könnten in Zukunft Hemmstoffe entwickelt werden, um eine Antikörper-Angriff gegen MOG im Körper zu verhindern oder zumindest abzuschwächen.
Weitere Informationen erhalten Sie von:
Max-Planck-Institut für Biochemie
Martinsried b. München
Constanze Breithaupt
Tel.: 089-8578-2824
E-Mail: breitha@biochem.mpg.de
Uwe Jacob
Tel.: 089-8578-2824
E-Mail: ujacob@biochem.mpg.de
Media Contact
Weitere Informationen:
http://www.biochem.mpg.deAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Neue universelle lichtbasierte Technik zur Kontrolle der Talpolarisation
Ein internationales Forscherteam berichtet in Nature über eine neue Methode, mit der zum ersten Mal die Talpolarisation in zentrosymmetrischen Bulk-Materialien auf eine nicht materialspezifische Weise erreicht wird. Diese „universelle Technik“…

Tumorzellen hebeln das Immunsystem früh aus
Neu entdeckter Mechanismus könnte Krebs-Immuntherapien deutlich verbessern. Tumore verhindern aktiv, dass sich Immunantworten durch sogenannte zytotoxische T-Zellen bilden, die den Krebs bekämpfen könnten. Wie das genau geschieht, beschreiben jetzt erstmals…

Immunzellen in den Startlöchern: „Allzeit bereit“ ist harte Arbeit
Wenn Krankheitserreger in den Körper eindringen, muss das Immunsystem sofort reagieren und eine Infektion verhindern oder eindämmen. Doch wie halten sich unsere Abwehrzellen bereit, wenn kein Angreifer in Sicht ist?…





















