Neues Verfahren vermisst aktive Zentren von Proteinen

Mit Hilfe der neuen Technik konnten die Forscher die Struktur des Proteins Ribonukleotid-Reduktase genauer bestimmen, welches eine Schlüsselrolle beim Bau der Erbsubstanz in jeder lebenden Zelle spielt. Die Erkenntnisse der Wissenschaftler ermöglichen neue Einblicke in die Struktur und Funktionsweise dieses lebenswichtigen Proteins. Von einem besseren Verständnis der Arbeitsweise des Proteins könnte zukünftig auch die medizinische Forschung profitieren, um Krebsmedikamente weiterzuentwickeln. (Angew. Chem. Int. Ed.47, 1224-1227, Februar 2008).
Als es James Watson und Francis Crick 1953 gelang, die Struktur der Erbsubstanz (der DNA) aufzuklären, war nur wenig darüber bekannt, wie diese in den Zellen zusammengebaut wird. Erst acht Jahre später entdeckten Wissenschaftler mit der Ribonukleotid-Reduktase (RNR) ein erstes Protein, welches für den Bau der DNA von entscheidender Bedeutung ist. Von den Bakterien bis hin zum Menschen übernimmt die RNR den letzten Schritt bei der Bildung der einzelnen DNA-Bausteine. Dabei schließen sich häufig zwei RNR-Proteine zu einem Komplex zusammen. Doch ist die Funktionsweise dieses Proteinkomplexes noch nicht vollständig verstanden – nicht zuletzt deshalb, weil sich die RNR-Proteine nicht ohne weiteres in Aktion beobachten lassen.
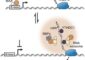
Dr. Marina Bennati, Forschungsgruppenleiterin am Göttinger Max-Planck-Institut für biophysikalische Chemie, gelang es nun, den Proteinkomplex direkt in Aktion zu vermessen. Dazu arbeitete die Wissenschaftlerin eng mit Kollegen der Universität Frankfurt und des Max-Planck-Instituts für Bioanorganische Chemie zusammen. Erstmalig setzten die Forscher eine neue hochsensitive Methode der Hochfeld-Elektronenspinresonanz-Spektroskopie ein, um die Bewegung und die Struktur der RNR zu untersuchen. „Mit Hilfe dieser neuen Technik können wir aktive Proteinkomplexe unter nahezu natürlichen Bedingungen messen, wie sie auch in der lebenden Zelle vorliegen“, erklärt Bennati.
Dabei machen sich die Wissenschaftler zunutze, dass der Proteinkomplex in seinen beiden aktiven Zentren je eine aktivierte Aminosäure enthält. „Mit Hilfe der Elektronenspinresonanz-Spektroskopie messen wir nicht nur den Abstand zwischen den beiden aktivierten Aminosäuren, sondern sehen auch ihre relative Orientierung“, erklärt die Projektleiterin. Die Methode gibt den Wissenschaftlern dabei nicht nur ein genaueres Bild der Proteinstruktur, sondern erlaubt ihnen auch neue Einblicke in die Funktionsweise des Proteinkomplexes. Entwickelt wurde das dazu verwendete Spektrometer in der Arbeitsgruppe von Professor Thomas Prisner an der Universität Frankfurt.
Proteine in aktivem Zustand in hoher räumlicher und zeitlicher Präzision zu studieren, ist nicht nur für die Grundlagenforschung von Bedeutung. Auch für die medizinische und pharmazeutische Forschung liefert sie wichtige Erkenntnisse bei der Entwicklung neuer Medikamente. Da die RNR immer dann gebraucht wird, wenn die Zelle sich teilt oder wenn DNA-Schäden repariert werden müssen, ist das Protein Gegenstand zahlreicher Untersuchungen für die Entwicklung von Medikamenten gegen Krebs. Von einem verbesserten Verständnis der Funktionsweise und Struktur des Proteins könnte zukünftig auch die medizinische und pharmazeutische Forschung bei der Weiterentwicklung dieser Krebsmedikamente profitieren.
Rückfragen bitte an:
Dr. Marina Bennati, Max-Planck-Institut für biophysikalische Chemie, Forschungsgruppe Elektronenspinresonanz-Spektroskopie, Am Faßberg 11, 37077 Göttingen, Tel: 0551 201-1911, Fax: -1467, Email: bennati@mpibpc.mpg.de
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Neuartiges Material für nachhaltiges Bauen
Innovativer Werkstoff für eine energieeffiziente Architektur: Forschende des Karlsruher Instituts für Technologie (KIT) stellen in der aktuellen Ausgabe der Fachzeitschrift Nature Communications ein polymerbasiertes Material mit besonderen Eigenschaften vor. Das…

Neues Antibiotikum gegen Erreger der Flussblindheit und Lymphatischen Filariose
Prof. Achim Hoerauf, Direktor des Instituts für Medizinische Mikrobiologie, Immunologie und Parasitologie des Universitätsklinikums Bonn (UKB), und seinem Team ist es in Kollaboration mit der Abteilung Pharmazeutische Technologie und Biopharmazie…
Evolutionäre Genomik: Folgen biodiverser Fortpflanzungssysteme
Die Deutsche Forschungsgemeinschaft (DFG) fördert die Einrichtung eines neuen Graduiertenkollegs (GRK) in der Biologie an der Universität Göttingen. Das GRK mit dem Titel „Evolutionary Genomics: Consequences of Biodiverse Reproductive Systems…