Präbiotische Peptidsynthese erstmals vollständig "in silico"

RUB-Chemiker untersuchen Peptidbindungen im virtuellen Labor
JACS-Communications berichtet
Über die Entstehung des „ersten Proteins“ auf rein chemischem Wege gibt es viele Spekulationen: Können, lange bevor es Lebewesen gab, Proteine aus Aminosäuren als Bausteinen quasi von selbst entstanden sein? RUB-Chemikern um Prof. Dr. Dominik Marx (Theoretische Chemie) haben jetzt unter Annahme präbiotischer Bedingungen gemäß der sog. „Eisen-Schwefel-Welt“-Hypothese eine vollständige Peptidsynthese am Computer durchgeführt. Der Hypothese zufolge könnten die so entstandenen Proteine erste Lebensbausteine sein. Die Studie wurde nun als eine der raren „Three-Page Communications to the Editor“ in der renommierten Zeitschrift Journal of the American Chemical Society (JACS) veröffentlicht.
Präbiotische Chemie
Eine von vielen Optionen, wie das Leben entstanden sein könnte, ist die Entstehung komplexer Biomoleküle auf rein chemischem Wege, also ohne Rückgriff auf ausgereifte biologische Synthesemaschinen wie das Ribosom. Entsprechende Spekulationen gehen auf Darwin selbst zurück, der in einem Brief an einen befreundeten Botaniker im Jahr 1871 entsprechende Vermutungen geäußert haben soll. („But if (and Oh! what a big if!) we could conceive in some warm little pond, with all sorts of ammonia and phosphoric salts, light, heat, electricity, etc., present, that a protein compound was chemically formed ready to undergo still more complex changes, …“). „Wir haben uns also gefragt: Wäre es tatsächlich möglich, dass sich in präbiotischer Zeit Proteine einfach spontan gebildet haben?“, erklärt Prof. Marx den Ausgangspunkt der Untersuchung, „und wenn ja, wie genau haben sie das getan?“
Eisen-Schwefel-Welt Szenario
Grundlage der aktuellen Studie ist einer der kontrovers diskutierten Vorschläge, das so genannte „Eisen-Schwefel-Welt“-Szenario, das der Chemiker Günter Wächterhäuser seit Mitte der 1980iger Jahre detailliert ausgearbeitet hat und seither der wissenschaftlichen Überprüfung preisgibt. Komponenten dieser Hypothese sind einerseits Oberflächen von Eisen-Schwefel-Mineralien und andererseits hohe Temperaturen und hoher Druck des Wassers als Medium, in dem die Synthese von Peptiden in einem „Peptidzyklus“ ablaufen soll. „Nun ist es natürlich ungemein schwierig, solche Reaktionen bei mehreren hundert Grad und Bar kontrolliert durchzuführen, um die Auswirkung dieser exotischen Reaktionsbedingungen studieren zu können“, gibt Dr. Nisanth Nair aus der Arbeitsgruppe Marx zu bedenken. Deshalb verlegten die Chemiker das Experiment ins Virtuelle Labor. Mit modernsten Simulationsmethoden ist es möglich, diese Extrembedingungen nicht nur herzustellen, sondern auch Eins zu Eins mit normalen Reaktionsbedingungen zu vergleichen. „Wir haben unsere kleine Probe zuzusagen im Computer einfach erhitzt, zusammengedrückt und geschaut was sich verändert!“, verdeutlicht Erstautor Dr. Eduard Schreiner.
Der Schlüssel: Wasser bei Extrembedingungen
„Überraschenderweise konnten wir feststellen, dass die für die Biochemie doch recht unüblichen Wächterhäuserschen Reaktionsbedingungen die Bildung von Peptidbindungen in der Tat beschleunigen“, beschreibt Professor Marx die Ergebnisse. Bedeutsam sei besonders, dass Wasser bei diesen exotischen Bedingungen völlig andere Eigenschaften hat als flüssiges Wasser etwa in der Wasserleitung, und genau das werde im Computer gut nachgestellt. „Der Aufwand dieser Studie war allerdings exorbitant, denn wir mussten fast zehn einzelne Reaktionsschritte sowie deren Rückreaktionen unter drei verschiedenen Reaktionsbedingungen simulieren, um nach vielen Fehlschlägen den Peptidzyklus zu knacken“, erzählt Eduard Schreiner, der sich damit seinen Doktorhut verdient hat.
Nur mit gigantischen Rechenmaschinen zum Erfolg
„Mit diesem Rechenaufwand stellt die nun publizierte Untersuchung wohl einen neuen Weltrekord auf dem Gebiet der ab initio Molekulardynamik auf“, berichtet Professor Marx nicht ohne Stolz. Möglich geworden ist das erst durch ausgiebige Nutzung eines IBM Blue Gene Parallelrechners am John von Neumann-Institut für Computing in Jülich. „Interessant ist in diesem Zusammenhang auch Darwins Bemerkung 'It is mere rubbish thinking at present of the origin of life; one might as well think of the origin of matter', fügt Marx hinzu, „denn genau solche Untersuchungen werden heute auf dem gleichem Supercomputer von Kollegen aus der Physik durchgeführt!“
Titelaufnahme
E. Schreiner, N. N. Nair, and D. Marx, Influence of Extreme Thermodynamic Conditions and Pyrite Surfaces on Peptide Synthesis in Aqueous Media, J. Am. Chem. Soc. („Three-Page Communication“ to the Editor), ASAP Article 10.1021/ja7108085; download from:
http://pubs.acs.org/cgi-bin/abstract.cgi/jacsat/asap/abs/ja7108085.html
Weitere Informationen
Professor Dominik Marx, Lehrstuhl für Theoretische Chemie der Ruhr-Universität Bochum, 44780 Bochum, NBCF 03/296, Tel. 0234/32-28083, Fax: 0234/32-14045, dominik.marx@theochem.rub.de
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge
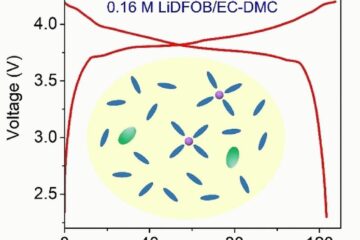
Für kostengünstigere, nachhaltigere Akkus
Ultraniedrig konzentrierter Elektrolyt für Lithium-Ionen-Batterien Lithium-Salze machen Akkumulatoren leistungsfähig, aber teuer. Ein ultraniedrig konzentrierter Elektrolyt auf Basis des Lithium-Salzes LiDFOB könnte eine kostengünstige und dabei nachhaltigere Alternative sein. Zellen mit…

Chemischer Seiltrick auf molekularer Ebene
Mechanismusforschung hilft, wenn „Trial & Error“ versagt. In den meisten industriellen chemischen Reaktionen verbinden sich Katalysatoren mit den Ausgangsstoffen und begleiten sie über Zwischenstufen zum Produkt. Dieser Weg wird in…
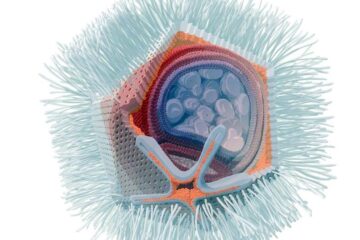
Riesenviren infizieren tödlichen Parasiten
Neues ungewöhnliches Riesenvirus in Kläranlage Klosterneuburg entdeckt. Der Einzeller Naegleria fowleri gehört zu den tödlichsten Parasiten für den Menschen. Forscher*innen des Zentrums für Mikrobiologie und Umweltsystemwissenschaft der Universität Wien um…





















