Neue Erkenntnisse zur Entstehung der Parkinson-Erkrankung

Jede Zelle verfügt über viele Mitochondrien, Zellorganellen, welche die Zelle mit überlebenswichtigen, energiereichen Molekülen versorgen. Krankhafte, geschädigte Mitochondrien dagegen produzieren keine Energie mehr.
Sie führen zu einer verstärkten Schädigung der Zelle durch zunehmenden oxidativen Stress, der zum Zelltod führen kann.Die Entsorgung fehlerhafter Mitochondrien (mitochondriale Autophagie oder Mitophagie) ermöglicht eine Säuberung der Zelle und schützt diese demnach vor geschädigten Mitochondrien und deren zerstörerischen Folgen. Die Tübinger Arbeitsgruppe um Dr. Wolfdieter Springer und Prof. Dr. Philipp Kahle belegen in der vorliegenden Studie erstmals, wie diese Entsorgung funktioniert: Die Proteine PINK1 und Parkin kennzeichnen gemeinsam die geschädigten Mitochondrien für den Abbau, indem sie einen an der Oberfläche der Mitochondrien befindlichen Kanal mit dem kleinen Protein Ubiquitin markieren.
Diese Markierung dient der Zelle als Signal zum Abbau geschädigter Mitochondrien. Fehlen die Proteine PINK1 oder Parkin durch eine Mutation, ist dieser Entsorgungsmechanismus gestört. Eine solche Störung könnte entscheidend an der Entstehung von Parkinson beteiligt sein, so die Vermutung der Tübinger Wissenschaftler. „Die Erkenntnisse dieser Studie könnten nun die Entwicklung von spezifischen Wirkstoffen ermöglichen, die ein Fehlen von PINK1 und Parkin kompensieren und den Entsorgungsmechanismus so steuern, dass nur geschädigte Mitochondrien abgebaut werden. Das wäre eine Perspektive, neurodegenerativen Krankheiten vorzubeugen,“ so der Leiter der Studie, Dr. Wolfdieter Springer.
Die Wissenschaftler konnten zeigen, dass Parkinson-assoziierte Mutationen den sequentiellen Prozess der Entsorgung an bestimmten Schritten verhindern. Die enzymatische Funktion der mitochondrialen Kinase PINK1 ist dabei essentiell und sorgt für eine prompte Rekrutierung und Anhaftung des ansonsten gleichmäßig in der Zellflüssigkeit verteilten Proteins Parkin an die geschädigten Mitochondrien. Die enzymatische Aktivität der Ubiquitin-Ligase Parkin wiederum ermöglicht nun die Markierung von VDAC1 mit dem kleinen Protein Ubiquitin, welches unter anderem als Signalmolekül für den Abbau derartig modifizierter Proteine dient. Interessanterweise bildet VDAC1 einen Kanal durch die äußere Membran der Mitochondrien und steht bereits unter Verdacht bei Schädigung der Mitochondrien entscheidend zum Zelltod beizutragen. Die identifizierte Ubiquitin-Markierung des VDAC1-Proteins wird anschließend von dem Adapter-Protein p62/SQSTM1 erkannt, welches somit das geschädigte Zellorganell als Ganzes zur Entsorgung der Autophagie-Maschinerie zuführt.
Bisher war bekannt, dass bei der Entstehung und im Verlauf der Parkinson-Erkrankung zum einen Störungen der zellulären Proteinabbauwege und zum anderen Fehlfunktionen in den Mitochondrien eine Rolle spielen und dass die krankheitsassoziierten Proteine PINK1 und Parkin dabei von entscheidender Bedeutung sind. Mit ihrer Entdeckung, dass PINK1 und Parkin die Entsorgung geschädigter Mitochondrien gemeinsam steuern, belegen die Forscher einen funktionellen Zusammenhang zwischen diesen beiden vermeintlichen Hauptursachen der Parkinson-Erkrankung.
Originaltitel der Publikation:
PINK1/Parkin-mediated mitophagy is dependent on VDAC1 and p62/SQSTM1
Autoren: Sven Geisler, Kira M. Holmström, Diana Skujat, Fabienne C. Fiesel, Oliver C. Rothfuss, Philipp J. Kahle und Wolfdieter Springer
Nature Cell Biology advance online publication 24.01.2010: http://dx.doi.org/10.1038/ncb2012
Kontakte:
Universitätsklinikum Tübingen, Zentrum für Neurologie
Hertie-Institut für klinische Hirnforschung (HIH)
Partnerstandort Deutsches Zentrum für Neurodegenerative Erkrankungen (DZNE)
Prof. Dr. Philipp Kahle
07071/29 81 970
philipp.kahle@uni-tuebingen.de
Dr. Wolfdieter Springer
Tel. 07071/29 82 038
wolfdieter.springer@klinikum.uni-tuebingen.de
http://www.hih-tuebingen.de
Hertie-Institut für klinische Hirnforschung (HIH)
Externe Pressestelle:
Kirstin Ahrens
Tel.: 07073-500 724, Mobil: 0173 – 300 53 96
Mail : mail@kirstin-ahrens.de
Universitätsklinikum Tübingen
Presse- und Öffentlichkeitsarbeit
Dr. Ellen Katz
Telefon: 07071-2980112
Mail: ellen.katz@med.uni-tuebingen.de
Media Contact
Alle Nachrichten aus der Kategorie: Studien Analysen
Hier bietet Ihnen der innovations report interessante Studien und Analysen u. a. aus den Bereichen Wirtschaft und Finanzen, Medizin und Pharma, Ökologie und Umwelt, Energie, Kommunikation und Medien, Verkehr, Arbeit, Familie und Freizeit.
Neueste Beiträge

Neue Spule für 7-Tesla MRT | Kopf und Hals gleichzeitig darstellen
Die Magnetresonanztomographie (MRT) ermöglicht detaillierte Einblicke in den Körper. Vor allem die Ultrahochfeld-Bildgebung mit Magnetfeldstärken von 7 Tesla und höher macht feinste anatomische Strukturen und funktionelle Prozesse sichtbar. Doch alleine…

Hybrid-Energiespeichersystem für moderne Energienetze
Projekt HyFlow: Leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem für moderne Energienetze. In drei Jahren Forschungsarbeit hat das Konsortium des EU-Projekts HyFlow ein extrem leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem entwickelt, das einen…
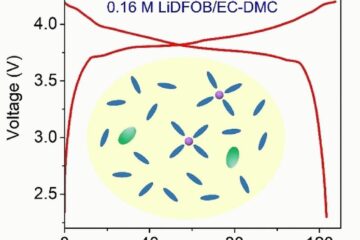
Für kostengünstigere, nachhaltigere Akkus
Ultraniedrig konzentrierter Elektrolyt für Lithium-Ionen-Batterien Lithium-Salze machen Akkumulatoren leistungsfähig, aber teuer. Ein ultraniedrig konzentrierter Elektrolyt auf Basis des Lithium-Salzes LiDFOB könnte eine kostengünstige und dabei nachhaltigere Alternative sein. Zellen mit…





















