„Zuckersüße Bindungspartner“ regulieren Alzheimer-Proteine
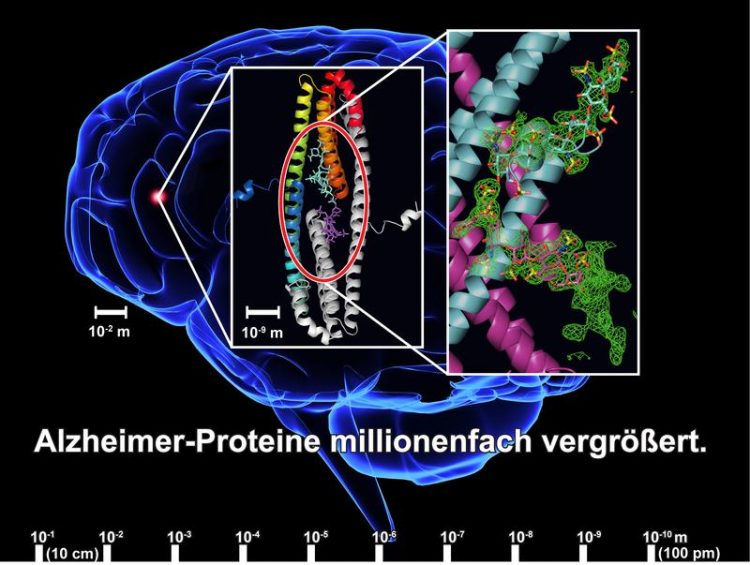
Durch Röntgenstrukturanalyse kann die Bindung zwischen dem APLP1-Protein und dem Zuckermolekül Heparansulfat sichtbar gemacht werden. Im Vergleich zum Gehirn sind diese Moleküle millionenfach kleiner [Grafik: Sven Dahms / FLI] Hinweis: Das zur Verfügung gestellte Bildmaterial darf nur im Zusammenhang mit dieser Pressemitteilung genutzt werden. (Quelle u.a. panthermedia.net)
Forschern des Jenaer Leibniz-Instituts für Altersforschung gelang es nun, die räumliche Struktur der Bindungsdomäne E2 von APLP1 (APP-Homolog) im Komplex mit Heparansulfaten (funktionelle Zucker) detailliert aufzuklären. Sie fanden, dass diese in verschiedenen Bindemodi mit der E2-Domäne wechselwirken und so unterschiedliche (patho)physiologische Funktionen des Proteins beeinflussen können.
Die Alzheimersche Krankheit ist weltweit die häufigste Form der Demenz und wird durch absterbende Nervenzellen im Gehirn verursacht. Sie führt im zunehmend schwereren Verlauf zu einem fortschreitenden Verlust der intellektuellen Fähigkeiten, wodurch z.B. das Gedächtnis, die Lernfähigkeit, die Orientierung und die Sprache betroffen sind. Über 1.2 Millionen Menschen sind bereits in Deutschland an Morbus Alzheimer erkrankt. Der Hauptrisikofaktor ist das fortschreitende Lebensalter.
Die Krankheit zeichnet sich durch die Ablagerung seniler Plaques im Gehirn aus, die vorwiegend aus amyloiden β-Peptiden (Aβ) bestehen; proteolytische Spaltprodukte des β-Amyloid-Vorläufer-Proteins (engl. β-amyloid precursor protein, APP). Die Proteine der APP-Familie besitzen ebenfalls eine zentrale Bedeutung für die neuronale Entwicklung und Selbsterneuerung von Zellen (Homöostase).
APP und die paralogen, APP-ähnlichen Proteine APLP1 und APLP2 enthalten die hoch konservierte, strukturelle E2-Domäne, die Heparansulfat bindet und somit verschiedene (patho)physiologische Funktionen des Proteins beeinflusst. Trotz intensiver Forschung zur Pathologie der Alzheimerschen Krankheit und der Beteiligung von APP und seinen Spaltprodukten sind insbesondere die physiologischen Funktionen dieser Proteinfamilie bis heute jedoch nur wenig verstanden.
In Zusammenarbeit mit Kollegen der Freien Universität Berlin und McGill University Montreal in Kanada ist es Forschern des Jenaer Leibniz-Instituts für Altersforschung – Fritz-Lipmann-Institut (FLI) nun erstmals gelungen, die räumliche Struktur der Bindungsdomäne E2 von APLP1 im Komplex mit Heparansulfaten, einer Klasse funktioneller Zucker, detailliert aufzuklären. Für die aktuelle Studie in dem Fachjournal Acta Crystallographica nutzten sie die Methode der Röntgenstrukturanalyse, um die Bindung des Zuckers an das Protein auf molekularer Ebene sichtbar zu machen.
„Aufgrund der sehr komplexen und multiplen Funktion von APP und seinen Homologen müssen wir zunächst viel Grundlagenforschung betreiben, um die Demenzerkrankung und ihre Entstehung fundamental besser verstehen zu können und um einer möglichen zukünftigen Therapie näherzukommen“, erklärt Dr. Manuel Than, Forschungsgruppenleiter am FLI.
„Die Röntgenstrukturanalyse des Heparansulfat- Komplexes mit APL1 ergab, dass – anders als bisher angenommen – diese funktionellen Zucker in zwei unterschiedlichen Bindemodi mit der E2-Domäne des APLP1 wechselwirken und es somit eine ganze Reihe verschiedener Komplexe zwischen APLP1-E2 und Heparansulfat gibt“, unterstreicht Than. „Diese spezifische Bindung kann Strukturänderungen im Protein auslösen; ein Indiz dafür, dass Heparansulfate in der Lage sind, die APLP1-Funktion zu regulieren“.
Die mit der E2-Domäne wechselwirkenden Heparansulfate sind eine sehr heterogene Klasse von langen Zuckerketten, die zum Teil an Proteine gebunden sind. „Ihre Bindung weist daher eine sehr heterogene Verteilung von Modifikationen und Ladung auf“, erläutert Dr. Sven Dahms, Postdoc am FLI.
„Wir sehen aufgrund der gefundenen Spezifität dieser Wechselwirkung, dass überhaupt nur bestimmte Typen von Heparansulfaten an das APLP1-Protein binden können“. „Aufgrund der hohen Ähnlichkeit ist dieser Mechanismus der Bindung höchstwahrscheinlich bei allen Mitgliedern der APP-Proteinfamilie zu finden, also auch beim Alzheimer-Protein APP“, schlussfolgern die Jenaer Forscher.
Bei der Alzheimerschen Krankheit treten im Verlauf der Erkrankung im Gehirn Entzündungsprozesse auf, die den Abbau von Heparansulfaten verstärken. „Ein veränderter Stoffwechsel dieser Zucker könnte sich daher entscheidend auf deren Interaktion mit den Proteinen der APP-Familie auswirken und dadurch pathologische Fehlfunktionen hervorrufen“, vermuten die Forscher aus Jena. „Mit unseren Ergebnissen konnten wir wieder einen weiteren zentralen Puzzlestein für das Verständnis der Krankheitsentwicklung aufzeigen.“
Publikation
Dahms SO, Mayer MC, Roeser D, Multhaup G, Than ME. Interaction of the amyloid precursor protein-like protein 1 (APLP1) E2 domain with heparan sulfate involves two distinct binding modes. Acta Crystallogr D Biol Crystallogr. 2015, 71(Pt 3), 494-504. doi: 10.1107/S1399004714027114
Kontakt:
Dr. Kerstin Wagner
Leibniz-Institut für Altersforschung – Fritz-Lipmann-Institut (FLI)
Beutenbergstr. 11, 07745 Jena
Tel.: 03641-656378, Fax: 03641-656351, E-Mail: presse@fli-leibniz.de
Hintergrundinfo
Das Leibniz-Institut für Altersforschung – Fritz-Lipmann-Institut (FLI) in Jena widmet sich seit 2004 der biomedizinischen Alternsforschung. Über 330 Mitarbeiter aus 30 Nationen forschen zu molekularen Mechanismen von Alternsprozessen und alternsbedingten Krankheiten. Näheres unter http://www.fli-leibniz.de.
Die Leibniz-Gemeinschaft verbindet 89 selbständige Forschungseinrichtungen. Deren Ausrichtung reicht von den Natur-, Ingenieur- und Umweltwissenschaften über die Wirtschafts-, Raum- und Sozialwissenschaften bis zu den Geisteswissenschaften. Leibniz-Institute bearbeiten gesellschaftlich, ökonomisch und ökologisch relevante Fragestellungen. Sie betreiben erkenntnis- und anwendungsorientierte Grundlagenforschung. Sie unterhalten wissenschaftliche Infrastrukturen und bieten forschungsbasierte Dienstleistungen an. Die Leibniz-Gemeinschaft setzt Schwerpunkte im Wissenstransfer in Richtung Politik, Wissenschaft, Wirtschaft und Öffentlichkeit. Leibniz-Institute pflegen intensive Kooperationen mit den Hochschulen ‑ u.a. in Form der WissenschaftsCampi ‑, mit der Industrie und anderen Partnern im In- und Ausland. Sie unterliegen einem maßstabsetzenden transparenten und unabhängigen Begutachtungsverfahren. Aufgrund ihrer gesamtstaatlichen Bedeutung fördern Bund und Länder die Institute der Leibniz-Gemeinschaft gemeinsam. Die Leibniz-Institute beschäftigen rund 17.200 Personen, darunter 8.200 Wissenschaftlerinnen und Wissenschaftler. Der Gesamtetat der Institute liegt bei 1,5 Milliarden Euro. Näheres unter http://www.leibniz-gemeinschaft.de.
http://www.fli-leibniz.de – Homepage Leibniz-Institut für Altersforschung – Fritz-Lipmann-Institut
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Ein Herz so groß wie ein Stecknadelkopf
Uni Osnabrück untersucht Herzklappen von Fruchtfliegen… Gerade einmal zweieinhalb Millimeter messen die Fruchtfliegen (Drosophila melanogaster), an denen die Arbeitsgruppe der Zoologie und Entwicklungsbiologie der Uni Osnabrück forscht. Für die Untersuchung…

Waldinventur per Drohne und KI
Im Kampf gegen den Klimawandel sind Mangroven wichtige Verbündete; sie speichern bis zu fünfmal mehr Treibhausgase als andere Bäume. Dank einer von Forschenden aus Mitgliedseinrichtungen der U Bremen Research Alliance…

Beschichtungsverfahren der Zukunft
LZH und Cutting Edge Coatings auf der Optatec… Auf der Optatec 2024 zeigen das Laser Zentrum Hannover e.V. (LZH) und die Cutting Edge Coatings GmbH (CEC) neue Möglichkeiten der Beschichtungsverfahren…





















