Zellhülle ist ein molekularer Flickenteppich

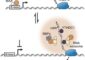
Die Membran der Hefezelle ist in verschiedene Domänen unterteilt (farbig markiert) und erscheint dadurch wie ein molekularer Flickenteppich. © MPI für Biochemie/Wedlich-Söldner <br>
Als Schaltstelle zwischen Zelle und Umwelt erfüllt die Zellmembran eine Vielzahl lebenswichtiger Funktionen. Wissenschaftler am Max-Planck-Institut für Biochemie in Martinsried bei München haben jetzt erstmals die molekulare Struktur der aus Fetten und Proteinen aufgebauten Grenzschicht umfassend analysiert und eine präzise Ordnung nachgewiesen:
Bei Hefezellen besteht die gesamte Membran aus sogenannten Domänen, die jeweils eine einzelne oder einige wenige Proteinsorten enthalten. Wird ein Protein in eine fremde Domäne versetzt, kann es sogar seine Funktion verlieren. Die Arbeit zeigt die Membran als eine Art molekularen Flickenteppich und könnte helfen, grundlegende Vorgänge in der Zelle besser zu verstehen.
Die Zellmembran muss viele Signale aus der Umwelt und dem Zellinneren verarbeiten, um bei Bedarf eine passende molekulare Antwort zu initiieren. Docken etwa bestimmte Botenstoffe an die Membran an, kann dies das Wachstum oder die Teilung einer Zelle auslösen. Die Zellmembran steht lange schon im Fokus der Wissenschaft. Weitgehend unklar war dennoch, wie sich ihre einzelnen Bestandteile genau anordnen. Einem frühen Modell zufolge sollten sich die Fette (Lipide) und in der Membran verankerten Proteine frei schwimmend und ohne feste Strukturen bewegen. Erst in den letzten Jahren wurde anhand einiger weniger Proteine eine Organisation in abgegrenzte Domänen nachgewiesen.
Forscher um Roland Wedlich-Söldner, Gruppenleiter am Max-Planck-Institut für Biochemie, haben nun erstmals die molekulare Struktur der Zellmembran umfassend analysiert. Sie nutzten dabei fortgeschrittene Mikroskopietechnik, die einzelne Bereiche der Zellmembran und darin angefärbte Proteine mit bislang unerreichter Deutlichkeit abbildete. Dabei erwies sich die Domäne nicht als Ausnahme, sondern als Regel: Jedes Protein in der Zellmembran liegt in klar abgegrenzten Arealen mit flecken- oder netzwerkartiger Struktur vor. Die Zellmembran besteht damit – wie eine Art molekularer Flickenteppich – flächendeckend aus Domänen.
„Manche Areale bestehen aus mehr als einer Art von Protein“, sagt Roland Wedlich-Söldner. „Auch wenn diese Moleküle ganz unterschiedliche Funktionen erfüllen, haben sie aber meist eines gemein: Sie sind über einen ähnlichen oder identischen molekularen Anker in einer gemeinsamen Domäne der Membran fixiert.“ Wie sehr die Proteine von dieser jeweils spezifischen Umgebung abhängen, konnten die Wissenschaftler in einem weiteren Versuch nachweisen: Sie tauschten bei einigen Proteinen den ursprünglichen Anker gegen eine andere molekulare Variante aus. Die veränderten Proteine gelangten dann in eine „fremde“ Domäne – passend zur neuen Verankerung. Dort aber konnten sie ihre Proteinfunktion nicht mehr erfüllen.
Wie aber finden Proteine die passende Domäne und bleiben dort, obwohl sie in der Membran relativ mobil sind? Die Forscher konnten zeigen, dass die Lipide der Zellmembran hier wohl den Ausschlag geben. Sie lagern sich jeweils bevorzugt an bestimmte Proteinanker an. So entstehen Areale, die für Proteine mit ähnlicher Verankerung besonders attraktiv sind. Dies könnte erklären, wie sich Zellmembranen selbst organisieren – eine weitere offene Frage in der Biologie. Die hochgeordnete Struktur der Zellmembran könnte aber auch helfen, deren vielen Funktionen besser zu verstehen. „Vermutlich laufen viele Prozesse nur dank der Domänenbildung in der Zellmembran effizient ab“, sagt Wedlich-Söldner. „Möglicherweise macht sich die Zelle zunutze, was auch im täglichen Leben gilt: Ein gewisses Maß an Ordnung erleichtert die Arbeit.“
Originalpublikation
F. Spira, N.S. Mueller, G. Beck, P. von Olshausen, J. Beig, and R. Wedlich-Söldner: Patchwork organization of the yeast plasma membrane into numerous coexisting domains. Nature Cell Biology, April 29, 2012.
DOI: 10.1038/ncb2487
Kontakt
Dr. Roland Wedlich-Söldner
Zelluläre Dynamik und Musterbildung
Max-Planck-Institut für Biochemie
Am Klopferspitz 18
82152 Martinsried
E-Mail: wedlich@biochem.mpg.de
www.biochem.mpg.de/wedlich/
Anja Konschak
Öffentlichkeitsarbeit
Max-Planck-Institut für Biochemie
Tel.: +49 (0) 89 8578-2824
E-Mail: konschak@biochem.mpg.de
Media Contact
Weitere Informationen:
http://www.mpg.de/5761526/zellmembran_patchworkAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Neuartiges Material für nachhaltiges Bauen
Innovativer Werkstoff für eine energieeffiziente Architektur: Forschende des Karlsruher Instituts für Technologie (KIT) stellen in der aktuellen Ausgabe der Fachzeitschrift Nature Communications ein polymerbasiertes Material mit besonderen Eigenschaften vor. Das…

Neues Antibiotikum gegen Erreger der Flussblindheit und Lymphatischen Filariose
Prof. Achim Hoerauf, Direktor des Instituts für Medizinische Mikrobiologie, Immunologie und Parasitologie des Universitätsklinikums Bonn (UKB), und seinem Team ist es in Kollaboration mit der Abteilung Pharmazeutische Technologie und Biopharmazie…
Evolutionäre Genomik: Folgen biodiverser Fortpflanzungssysteme
Die Deutsche Forschungsgemeinschaft (DFG) fördert die Einrichtung eines neuen Graduiertenkollegs (GRK) in der Biologie an der Universität Göttingen. Das GRK mit dem Titel „Evolutionary Genomics: Consequences of Biodiverse Reproductive Systems…