Wenn Bakterien Häuser bauen
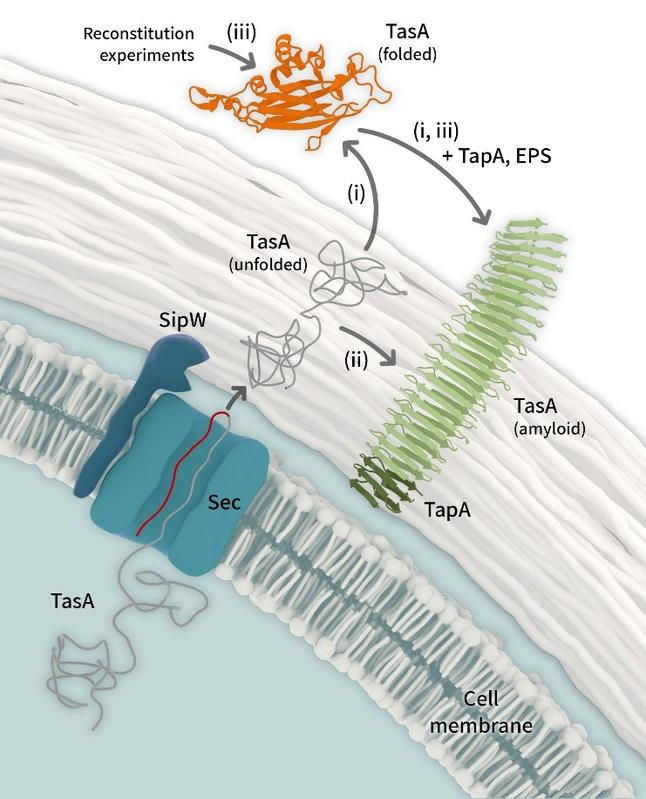
Bacillus subtilis Fibrillen Bildung erfolgt nach TasA-Export (i, ii) bzw. wenn gereinigtes TasA einer tasA Mutante in einem Rekonstitutionsexperiment (iii) zugeführt wird. Barth van Rossum, FMP
Der wichtigste Baustein des Biofilms – das Protein TasA – wird überraschenderweise bereits im Zellinneren vorgeformt. Gelangt TasA nach außen, bilden diese Bausteine längere Ketten, sogenannte Fibrillen, die wie ein Grundgerüst bzw. Mauern den Biofilm stabilisieren.
Biofilme können auch für den Menschen eine Gefahr darstellen, da sie Krankheitserregern Schutz vor den Waffen des Immunsystems und Antibiotika bieten. Um die Ausbildung von Biofilmen zu hemmen und die Wirksamkeit von Antibiotika zu garantieren, ist es notwendig, die Struktur der Bausteine zu kennen.
TasA ist ein überraschend dynamisches Protein
Auf Anregung des B. subtilis-Experten Kürşad Turgay von der Universität Hannover haben die Berliner Forscherinnen die molekulare Struktur des wichtigsten Proteins in diesem Biofilm, TasA, nun gelöst. Anne Diehl aus der von Hartmut Oschkinat geleiteten Abteilung „NMR-unterstützte Strukturforschung“ des FMP startete mit der Produktion von TasA und studierte die verschiedenen Erscheinungsformen des Proteins, die leicht ineinander übergehen.
Dabei tat sich dafür eine unerwartete Hürde auf: „Ich habe in den 32 Jahren meiner Berufstätigkeit auf dem Gebiet der Proteinstrukturforschung noch nie mit einem so dynamischen Protein gearbeitet. Bereits nach kurzer Zeit lagern sich die löslichen TasA-Proteine zusammen und erzeugen einen Gelee-artigen Zustand“, so Anne Diehl im Rückblick auf die erfolgreiche Charakterisierung der einzelnen Zustände.
Ein robuster Kern mit flexiblen Schlaufen
Einen möglichen Grund fand Yvette Roske aus der Abteilung „Makromolekulare Strukturen und Interaktionen“ des MDC, geleitet von Udo Heinemann. Ausgehend von frisch gereinigtem TasA züchtete sie Kristalle, analysierte diese mittels hochenergetischer Röntgenstrahlung am BESSY in Berlin-Adlershof und entschlüsselte so die dreidimensionale Faltung des Proteins.
„Es zeigte sich, dass die Struktur von TasA in weiten Bereichen hoch geordnet ist. Ein großer Anteil an ß-Faltblatt-Elementen verleiht dem Protein einen robusten Kern, der jedoch mit flexiblen Schlaufen dekoriert ist“, fasst Yvette Roske ihre Erkenntnisse zusammen.
Interessanterweise gehört die Aminosäure Arginin nicht zu den Bestandteilen von TasA. Durchschnittlich bestehen Proteine zu 10 % aus dieser basischen Aminosäure, das ist doppelt so viel, wie eine statistische Verteilung aller 20 vorkommender Aminosäuren erwarten lässt. „Dass ein Protein gänzlich auf diesen Grundbaustein verzichtet, muss einen Grund haben“, erläutert Anne Diehl.
Arginin dient häufig als Ansatzpunkt für Proteasen – Enzyme, die andere Proteine zerschneiden. Die Abwesenheit von Arginin erklärt möglicherweise die außerordentliche Stabilität von TasA gegenüber Proteasen und macht dieses Protein damit zu einem robusten Stützpfeiler des schützenden Biofilms.
TasA könnte erklären, warum Bacillus subtilis nicht pathogen ist
Dabei ähnelt die Aminosäureabfolge in TasA einer Protease mit Namen Camelysin, die viele pathogene Bacillus-Stämme an Stelle von TasA als Grundgerüst für ihre Biofilme nutzen. Die Struktur von TasA erlaubte daher die Konstruktion eines Modells für Camelysin.
„Unser Strukturmodell für Camelysin zeigt, dass die dreidimensionale Faltung der beiden Proteine mit hoher Wahrscheinlichkeit sehr ähnlich ist“, sagt Yvette Roske. Doch während das Camelysin des Milzbrand-Erregers B. anthracis eine Protease ist, fehlt dem TasA des harmlosen B. subtilis diese Eigenschaft. TasA scheint im Laufe der Evolution diese enzymatische Aktivität und damit seine Pathogenität verloren zu haben.
Die Erforschung der Biofilme geht nun in die nächste Phase. Mit Hilfe der Festkörper-NMR konnten die Teams vom FMP und MDC bereits zeigen, dass sich zuvor ungeordnete flexible Teile von TasA neu ausrichten, wenn sich die Bausteine zu Fibrillen zusammenlagern. Weitere Untersuchungen der Fibrillen sollen dazu beitragen, die Stabilität der Biofilme besser zu verstehen und vielleicht sogar neue Ansätze im Kampf gegen Krankheitserreger zu finden.
Quelle:
Anne Diehl, Yvette Roske, Linda Ball, Anup Chowdhury, Matthias Hiller, Noel Molière, Regina Kramer, Daniel Stöppler, Catherine L. Worth, Brigitte Schlegel, Martina Leidert, Nils Cremer, Natalja Erdmann, Daniel Lopez, Heike Stephanowitz, Eberhard Kraus, Barth-Jan van Rossum, Peter Schmieder, Udo Heinemann, Kürşad Turgay, Ümit Akbey, and Hartmut Oschkinat. Structural changes of TasA in biofilm formation of Bacillus subtilis, PNAS 12. März 2018, DOI 10.1073/pnas.1718102115
Bildunterschrift (ausführlich):
Bacillus subtilis Fibrillen Bildung erfolgt nach TasA-Export (i, ii) bzw. wenn gereinigtes TasA einer tasA Mutante in einem Rekonstitutionsexperiment (iii) zugeführt wird. In allen Fällen, insbesondere jedoch bei (iii) wird eine unterstützende Funktion von TapA und Exopolysacchariden (nicht dargestellt) erwartet.
Kontakt:
Prof. Dr. Hartmut Oschkinat
Leibniz-Forschungsinstitut für Molekulare Pharmakologie (FMP)
oschkinat@fmp-berlin.de
Tel. +49 30 94793-160
www.leibniz-fmp.de/oschkinat
Dr. Anne Diehl
Leibniz-Forschungsinstitut für Molekulare Pharmakologie (FMP)
diehl@fmp-berlin.de
Tel. +49 30 94793-310
Öffentlichkeitsarbeit
Silke Oßwald
Leibniz-Forschungsinstitut für Molekulare Pharmakologie (FMP)
osswald@fmp-berlin.de
Tel. +49 30 94793-104
Das Leibniz-Institut für Molekulare Pharmakologie (FMP) gehört zum Forschungsverbund Berlin e.V. (FVB), einem Zusammenschluss von acht natur-, lebens- und umweltwissenschaftlichen Instituten in Berlin. In ihnen arbeiten mehr als 1.900 Mitarbeiter. Die vielfach ausgezeichneten Einrichtungen sind Mitglieder der Leibniz-Gemeinschaft. Entstanden ist der Forschungsverbund 1992 in einer einzigartigen historischen Situation aus der ehemaligen Akademie der Wissenschaften der DDR.
http://www.pnas.org/content/early/2018/03/07/1718102115
http://www.leibniz-fmp.de/oschkinat
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Diamantstaub leuchtet hell in Magnetresonanztomographie
Mögliche Alternative zum weit verbreiteten Kontrastmittel Gadolinium. Eine unerwartete Entdeckung machte eine Wissenschaftlerin des Max-Planck-Instituts für Intelligente Systeme in Stuttgart: Nanometerkleine Diamantpartikel, die eigentlich für einen ganz anderen Zweck bestimmt…

Neue Spule für 7-Tesla MRT | Kopf und Hals gleichzeitig darstellen
Die Magnetresonanztomographie (MRT) ermöglicht detaillierte Einblicke in den Körper. Vor allem die Ultrahochfeld-Bildgebung mit Magnetfeldstärken von 7 Tesla und höher macht feinste anatomische Strukturen und funktionelle Prozesse sichtbar. Doch alleine…

Hybrid-Energiespeichersystem für moderne Energienetze
Projekt HyFlow: Leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem für moderne Energienetze. In drei Jahren Forschungsarbeit hat das Konsortium des EU-Projekts HyFlow ein extrem leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem entwickelt, das einen…





















