Den Tricks der Tuberkulose-Bakterien auf der Spur
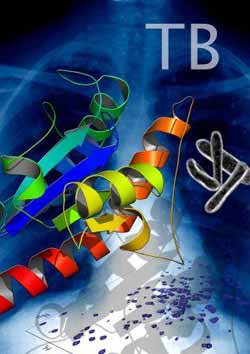
Struktur des Proteins MptpA, das Tuberkulosebakterien (rechts) freigesetzen, um nicht von Makrophagen verdaut zu werden. Hintergrund: Torax Aufnahme von TBC Patient, Boden NMR-Spektrum von MptpA.<br><br>Illustration: Tanja Stehle<br>
Bisher ist nur ansatzweise erforscht, warum das so ist. Eine wichtige Rolle spielt dabei ein spezifisches Protein, das von den Bakterien freigesetzt wird, um deren Überleben in Makrophagen zu sichern.
Ein Forscherteam der Goethe-Universität hat die Struktur und Dynamik dieses Proteins jetzt aufgeklärt und herausgefunden, warum es bisher nicht durch spezifische Wirkstoffe ausgeschaltet werden konnte.
Ein mit Tuberkulose infizierter Mensch wird in der Regel erst krank, wenn sein Immunsystem geschwächt ist, etwa durch Alkoholismus, AIDS oder das Immunsystem unterdrückende Medikamente. Bis zu diesem Zeitpunkt kapseln die Fresszellen (Makrophagen) die Eindringlinge ein. Könnte man ein spezifisches Protein ausschalten, mit dem die Bakterien sich ihrer Vernichtung durch Makrophagen widersetzen, hätte man das Problem bei der Wurzel gepackt und könnte Antibiotika-Therapien deutlich sparsamer einsetzen. In der aktuellen Ausgabe des Journal of Biological Chemistry geben Chemiker nun detaillierte Hinweise für das Wirkstoffdesign.
Bei dem untersuchten Protein handelt es sich um die Protein Tyrosin Phosphatase A, kurz MptpA, mit einer Bindungstasche für Reaktionspartner. In MptpA gibt es drei flexible Molekülregionen, die zusammen eine Art Tasche bilden. Sobald ein Bindungspartner an diese Regionen andockt, ändern sie ihre Orientierung und gehen von einer offenen in eine geschlossene Konformation über, ähnlich wie bei einem Rucksack, den man zuschnürt und schließt. Um das Protein durch einen Wirkstoff gezielt ausschalten zu können, müsste man diesen so entwerfen, dass er optimal in die Bindungstasche passt und mit ihr eine starke Bindung eingeht. Damit wäre eine Manipulation der Makrophagen durch MptpA nicht mehr möglich und das Tuberkulosebakterium würde verdaut werden, wie die meisten anderen Bakterien auch.
„Das Problem ist, dass man bisher nur Strukturdaten von MptpA im gebundenen Zustand kannte. Das war für ein computergestütztes Wirkstoffdesign irreführend, denn die Bindungstasche erscheint dann viel enger“, erklärt die Chemikerin Tanja Stehle, die das Protein im Rahmen ihrer Doktorarbeit am Institut für Organische Chemie und Chemische Biologie von Prof. Harald Schwalbe untersuchte.
„Die Lösung bestand darin, das ungebundene Protein mittels NMR-Spektroskopie in wässriger Lösung zu untersuchen“, berichtet Dr. Henry Jonker, Postdoktorand im Arbeitskreis von Prof. Schwalbe. Dazu haben die Chemiker das MptpA zusätzlich mit nicht-radioaktiven Isotopen markiert. Aus den Experimenten konnte durch aufwändige Rechnungen nicht nur die Struktur des ungebundenen Proteins, sondern auch seine Dynamik aufgeklärt werden. „Tatsächlich hat der Rucksack eine größere Öffnung, als bisher angenommen, wir haben also mehr Platz fürs Wirkstoffdesign“, fasst Stehle die wichtigste Erkenntnis zusammen. Die neuen Strukturdaten sollten es nun Wirkstoff-Designern ermöglichen, Moleküle zu entwerfen, die das MptpA gezielt blockieren können.
Publikation:
Tanja Stehle et al.: The Apo-structure of the Low Molecular Weight Protein-tyrosine Phosphatase A (MptpA) from Mycobacterium tuberculosis Allows for Better Target-specific Drug Development, Journal of Chemical Biology, Vol. 287, Issue 41, 34569-34582, October 5, 2012, DOI: 10.1074/jbc.M112.399261.
Informationen:
Prof. Harald Schwalbe, Institut für Organische Chemie und Chemische Biologie, Campus Riedberg, Tel.: 069-798-29737, schwalbe@nmr.uni-frankfurt.de.
Diplom-Chemikerin Tanja Stehle, Tel.: 069-798-29933, stehle@nmr.uni-frankfurt.de.
Dr. Henry Jonker, Tel.: 069-798-29137, h.jonker@nmr.uni-frankfurt.de.
Die Goethe-Universität ist eine forschungsstarke Hochschule in der europäischen Finanzmetropole Frankfurt. 1914 von Frankfurter Bürgern gegründet, ist sie heute eine der zehn drittmittelstärksten und größten Universitäten Deutschlands. Am 1. Januar 2008 gewann sie mit der Rückkehr zu ihren historischen Wurzeln als Stiftungsuniversität ein einzigartiges Maß an Eigenständigkeit. Parallel dazu erhält die Universität auch baulich ein neues Gesicht. Rund um das historische Poelzig-Ensemble im Frankfurter Westend entsteht ein neuer Campus, der ästhetische und funktionale Maßstäbe setzt. Die „Science City“ auf dem Riedberg vereint die naturwissenschaftlichen Fachbereiche in unmittelbarer Nachbarschaft zu zwei Max-Planck-Instituten. Mit über 55 Stiftungs- und Stiftungsgastprofessuren nimmt die Goethe-Universität laut Stifterverband eine Führungsrolle ein.
Herausgeber:
Der Präsident
Abteilung Marketing und Kommunikation,
Postfach 11 19 32, 60054 Frankfurt am Main
Redaktion:
Dr. Anne Hardy, Referentin für Wissenschaftskommunikation
Telefon (069) 798 – 2 92 28, Telefax (069) 798 – 2 85 30,
E-Mail hardy@pvw.uni-frankfurt.de
Media Contact
Weitere Informationen:
http://www.uni-frankfurt.deAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Neue universelle lichtbasierte Technik zur Kontrolle der Talpolarisation
Ein internationales Forscherteam berichtet in Nature über eine neue Methode, mit der zum ersten Mal die Talpolarisation in zentrosymmetrischen Bulk-Materialien auf eine nicht materialspezifische Weise erreicht wird. Diese „universelle Technik“…

Tumorzellen hebeln das Immunsystem früh aus
Neu entdeckter Mechanismus könnte Krebs-Immuntherapien deutlich verbessern. Tumore verhindern aktiv, dass sich Immunantworten durch sogenannte zytotoxische T-Zellen bilden, die den Krebs bekämpfen könnten. Wie das genau geschieht, beschreiben jetzt erstmals…

Immunzellen in den Startlöchern: „Allzeit bereit“ ist harte Arbeit
Wenn Krankheitserreger in den Körper eindringen, muss das Immunsystem sofort reagieren und eine Infektion verhindern oder eindämmen. Doch wie halten sich unsere Abwehrzellen bereit, wenn kein Angreifer in Sicht ist?…





















