Mitochondrien – Spezialschleuse für Sperrgut
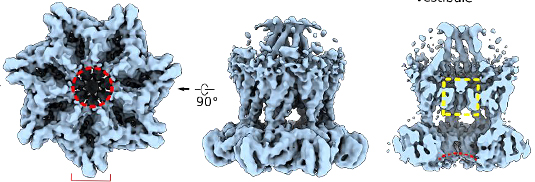
Struktur von Bcs1. Die zentrale ringförmige Pore ist durch einen gestrichelten roten Kreis gekennzeichnet, der Verschluss zwischen Matrixkammer und innerer Kammer durch das gestrichelte gelbe Feld. Quelle: Kater et. al, NSMB 2020
Viele Proteine mit wichtigen Funktionen müssen innerhalb der Zelle durch Membranen geschleust werden, um ihren Einsatzort zu erreichen. In der Regel erfolgt der Transport, solange die Proteine noch nicht in ihre dreidimensionale Struktur gefaltet sind, da dann relativ kleine Poren ausreichen.
Müssen gefaltete Proteine transportiert werden, gestaltet sich das schwieriger, da dann ein größeres Loch in der Membran geöffnet werden muss. Vor allem Bakterien und Chloroplasten besitzen hierfür eine besondere Schleuse.
In Mitochondrien allerdings ist diese Schleuse verlorengegangen – trotzdem muss ein wichtiges Protein gefaltet durch ihre innere Membran gelangen.
Wissenschaftler um Professor Roland Beckmann vom Genzentrum der LMU haben nun den zugehörigen Mechanismus identifiziert und zeigen: Er funktioniert ähnlich wie eine Luftschleuse. Über ihre Ergebnisse berichten die Wissenschaftler im Fachmagazin Nature Structural and Molecular Biology.
Das sogenannte Rieskeprotein (Rip1) ist ein wichtiger Baustein der Atmungskette, mit der Mitochondrien die universelle Energiewährung der Zelle – das ATP – produzieren.
Der Vorläufer dieses Proteins wird aus dem Zellinneren ungefaltet durch die Doppelmembran des Mitochondriums in dessen Innenraum transportiert.
Dort wird ein kugelförmiger Proteinabschnitt, eine sogenannte Eisen-Schwefel-Cluster-Domäne, in eine 3D-Struktur gefaltet, die anschließend wieder durch die innere Membran geschleust werden muss.
„Aus früheren Arbeiten unserer Kooperationspartner Walter Neupert und Nikola Wagener war bereits bekannt, dass das sogenannte Bcs1-Enzym an diesem Transport beteiligt ist“, sagt Lukas Kater, der Erstautor der Arbeit.
„Nun haben wir im Kryoelektronenmikroskop die 3D-Struktur dieses Enzyms bestimmt – und damit die erste hochaufgelöste Struktur eines eukaryotischen Translokationssystems für gefaltete Proteine überhaupt aufgeklärt.“
Mithilfe dieser Strukturanalysen untersuchten die Wissenschaftler, wie das Enzym es schafft, selektiv den gefalteten Proteinabschnitt durch die Membran zu schleusen, ohne dass dabei größere Mengen anderer Moleküle oder Ionen „mitrutschen“.
Zur Überraschung der Wissenschaftler zeigte sich, dass Bcs1 ein Heptamer ist, also aus sieben Bausteinen besteht, die eine ringförmige Pore bilden. Dadurch kann das Enzym eine deutlich größere zentrale Pore bilden als vergleichbare Enzyme, die nur aus sechs Bausteinen bestehen.
Zudem hat Bcs1 eine einzigartige Struktur: Es besitzt zwei Kammern, von denen die eine im Inneren des Mitochondriums liegt und die andere in der inneren Membran. Zwischen den beiden Kammern bilden bestimmte Enzym-Domänen einen Verschluss, der sich vorübergehend öffnen kann, wie die Wissenschaftler zeigten.
„Deshalb schlagen wir einen Mechanismus vor, der dem einer Luftschleuse ähnelt“, sagt Beckmann. Das Rieskeprotein gelangt dabei zuerst durch die große zentrale Pore in die Matrixkammer. Dann kommt es zu einer Konformationsänderung von Bcs1, durch die sich der Verschluss zwischen den beiden Kammern öffnet.
Jetzt gelangt das Rieskeprotein in die eigentliche Schleusenkammer, also in die Kammer in der inneren Membran. Im nächsten Schritt schließt sich der Verschluss zwischen beiden Kammern wieder.
„Wir vermuten, dass sich anschließend in der Schleusenkammer ein Durchgang öffnet, durch den die gefaltete Eisen-Schwefel-Cluster-Domäne dann in den Zwischenraum der mitochondrialen Doppelmembran gelangt“, sagt Kater.
Mit ihren Ergebnissen haben die Wissenschaftler nicht nur erste Einblicke in die Funktionsweise des Bcs1-Proteins erhalten, es gibt auch eine Reihe von Stoffwechselerkrankungen, die mit dem Protein zusammenhängen, beispielsweise das GRACILE-Syndrom, das zu einem frühen Tod führt, sowie das Björnstad-Syndrom. Deshalb könnte nach Ansicht der Wissenschaftler die Struktur des Proteins verstehen helfen, wie die zugrundeliegenden Mutationen diese Krankheitsbilder verursachen.
Nature Structural and Molecular Biology 2020
Wissenschaftliche Ansprechpartner:
Prof. Dr. Roland Beckmann
Gene Center and Department of Biochemistry
Tel.: +49 (0)89 / 2180 76900
E-Mail: beckmann@genzentrum.lmu.de
Web: http://www.beckmann.genzentrum.lmu.de/roland-beckmann/
Structure of the Bcs1 AAA-ATPase suggests an airlock-like translocation 3 mechanism for folded proteins
Lukas Kater, Nikola Wagener, Otto Berninghausen, Thomas Becker, Walter Neupert, Roland Beckmann
Nature Structural and Molecular Biology 2020
https://www.nature.com/articles/s41594-019-0364-1
Media Contact
Weitere Informationen:
https://www.uni-muenchen.de/forschung/news/2020/beckmann_luftschleuse.htmlAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Diamantstaub leuchtet hell in Magnetresonanztomographie
Mögliche Alternative zum weit verbreiteten Kontrastmittel Gadolinium. Eine unerwartete Entdeckung machte eine Wissenschaftlerin des Max-Planck-Instituts für Intelligente Systeme in Stuttgart: Nanometerkleine Diamantpartikel, die eigentlich für einen ganz anderen Zweck bestimmt…

Neue Spule für 7-Tesla MRT | Kopf und Hals gleichzeitig darstellen
Die Magnetresonanztomographie (MRT) ermöglicht detaillierte Einblicke in den Körper. Vor allem die Ultrahochfeld-Bildgebung mit Magnetfeldstärken von 7 Tesla und höher macht feinste anatomische Strukturen und funktionelle Prozesse sichtbar. Doch alleine…

Hybrid-Energiespeichersystem für moderne Energienetze
Projekt HyFlow: Leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem für moderne Energienetze. In drei Jahren Forschungsarbeit hat das Konsortium des EU-Projekts HyFlow ein extrem leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem entwickelt, das einen…





















