Meilenstein für Parkinson-Forschung: Amyloid-Protein α-Synuclein erstmals in Zelle sichtbar gemacht
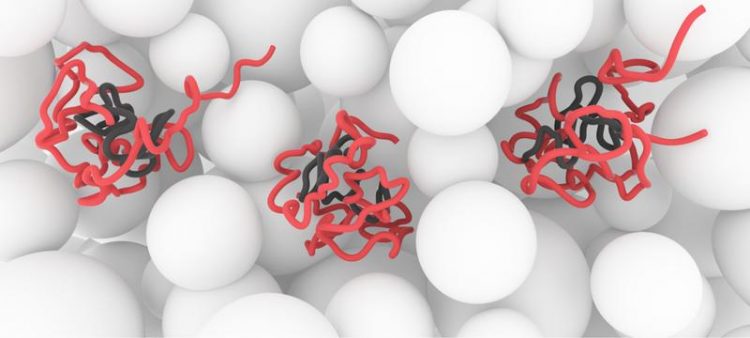
Zustand des Proteins α-Synuclein in lebenden, gesunden Zellen: Die zentrale NAC-Region (grau) ist gut geschützt. Das Protein sorgt dafür, dass es zu keiner Interaktion mit dem Zytoplasma (weiß) und anderen Zell-Komponenten kommt. Bei neurodegenerativen Veränderungen würden die grauen Bereiche zusammenwachsen und Amyloid-Strukturen ausbilden. Philipp Selenko, FMP
Neurodegenerative Erkrankungen wie Parkinson, Alzheimer oder Huntington haben eines gemeinsam: Im Gehirn lagern sich sogenannte Amyloid-Aggregate ab. Amyloid ist der Oberbegriff für Protein-Fragmente, die der Körper produziert, und die letztlich zum Untergang von Nervenzellen führen.
Das Protein α-Synuclein ist eine der Hauptkomponenten der Amyloid-Aggregate und spielt daher bei der Entstehung von Parkinson eine große Rolle. Über die strukturellen Aspekte dieser Aggregate ist viel bekannt.
So weiß man, dass α-Synuclein eine sehr konkrete Struktur hat, ihm also ein Bauplan zugrunde liegt, der einem bestimmten Muster folgt. Und man weiß, dass im Gegensatz dazu das isolierte, aufgereinigte Protein keinerlei Struktur besitzt.
Doch wie α-Synuclein innerhalb einer gesunden Zelle aussieht, war bislang unbekannt. Dabei lassen sich krankhafte Veränderungen nur dann umfassend erklären, wenn man auch den ursprünglichen Zustand des Proteins kennt. Forscher vom Leibniz-Institut für Molekulare Pharmakologie (FMP) in Berlin haben deshalb die Beschaffenheit des Proteins in gesunden Zellen buchstäblich unter die Lupe genommen.
Als erstes Forscherteam weltweit gelang es ihnen, α-Synuclein in neuronale und nicht-neuronale Zellen zu überführen – und sichtbar zu machen. Möglich machte das eine Kombination aus der Kernspinresonanz-Spektroskopie (NMR) und der Elektronenspinresonanz- Spektroskopie (EPR), zwei Verfahren, die es mit atomarer Auflösung erlauben, die strukturellen Begebenheiten eines Proteins zu charakterisieren.
„Kennen jetzt den Ausgangspunkt von α-Synuclein“
„Wir fanden jenen strukturlosen Zustand vor, den das Protein auch in aufgereinigtem Zustand hat“, erläutert Dr. Philipp Selenko, Leiter der Forschungsgruppe In-cell NMR Spectroscopy, die in den Fachmagazinen „Nature“ und „Nature Communications“ publizierten Forschungsergebnisse. „Das ist eigentlich sehr überraschend, weil man sich bisher nicht vorstellen konnte, wie so ein strukturloser Zustand überhaupt in einem zellulären Milieu überlebt.“
Anscheinend können Zellen aber sehr wohl mit unstrukturierten Proteinen umgehen. Die in „Nature“ publizierten Aufnahmen zeigen, wie das Protein in der gesunden Zelle die so genannte NAC-Region vor dem Eindringen fremder Moleküle schützt. Diese zentrale Region ist maßgeblich an der Ausbildung der hochstrukturellen Amyloid-Aggregate beteiligt. Warum die schützenden Eigenschaften des Proteins bei neurodegenerativen Krankheiten verlorengehen, ist eine der Kernfragen, mit denen sich die Forschung künftig beschäftigen wird.
„Im kranken Zustand muss sich dieses Protein strukturell so verändern, dass die NAC-Region für andere Moleküle zugänglich wird, so dass sich diese Regionen aneinander anlagern können, zu wachsen beginnen und dadurch die Amyloid-Strukturen ausbilden“, vermutet Biophysiker Selenko.
Dem Protein bei der Strukturveränderung zusehen
Der Fund aus Berlin legt die Basis, diesen strukturellen Veränderungen nun auf den Grund zu gehen. Konkrete Pläne für die kommenden Monate haben die FMP-Forscher schon. Mit ein paar Tricks werden sie künstlich gealterte Zellen herstellen und mit denselben spektroskopischen Verfahren das Amyloid-Protein einschleusen und beobachten.
Die Alterssimulation erfolgt deshalb, weil Parkinson und andere neurodegenerative Krankheiten Alterserkrankungen sind. Schließlich wollen die Forscher jenen Zustand konstruieren, der dem Krankheitsursprung entspricht. „Wir hoffen dem Protein zuschauen zu können, wie der Schutz der NAC-Region allmählich verlorengeht und wie es beginnt, amyloid-ähnliche Strukturen zu bilden“, sagt Forschungsgruppenleiter Selenko.
In der in „Nature Communications“ publizierten Studie hatte das Forscherteam diesbezüglich bereits eine spannende Entdeckung gemacht: Dem Protein α-Synuclein hatten sie an mehreren Stellen Schäden zugefügt, so wie es normalerweise in einer gealterten Zelle der Fall ist. Anschließend wurde das Protein in eine junge, gesunde Zelle eingebracht. Dort beobachteten die Forscher dann, wie die Zelle die Defekte in einigen Regionen verblüffend perfekt reparieren konnte, in anderen jedoch nicht. Die Region, die nicht repariert werden konnte, war jene, die immens wichtig für die Funktion des Proteins ist.
Entdeckung der Krankheitsursache rückt näher
In der nun anstehenden Studie wollen die Forscher einen umfassenden Einblick gewinnen, welche Defekte die Reparationsmechanismen zum Kippen bringen und den neurodegenerativen Prozessen den Boden bereiten. Philipp Selenko zufolge liegt hierin der Schlüssel, um endlich die Krankheitsursache zu finden und dadurch eines Tages in den zerstörerischen Prozess eingreifen zu können – mit Wirkstoffen, die es dann zu entwickeln gilt. „Mit unserer Entdeckung des Ausgangszustandes des Proteins haben wir dafür den entscheidenden ersten Schritt getan“, so Selenko.
Quellen:
Francois-Xavier Theillet, Andres Binolfi, Beata Bekei, Andrea Martorana, Honor May Rose, Marchel Stuiver, Silvia Verzini, Dorothea Lorenz, Marleen van Rossum, Daniella Goldfarb & Philipp Selenko, Structural disorder of monomeric a-synuclein persists in mammalian cells, Nature 2016, doi:10.1038/nature16531
Andres Binolfi, Antonio Limatola, Silvia Verzini, Jonas Kosten, Francois-Xavier Theillet, Honor May Rose, Beata Bekei, Marchel Stuiver, Marleen van Rossum & Philipp Selenko, Intracellular repair of oxidation-damaged a-synuclein fails to target C-terminal modification sites.
Nature Communications 2016, doi: 10.1038/ncomms10251
Text: Beatrice Hamberger
Dr. Philipp Selenko
Leibniz-Institut für Molekulare Pharmakologie(FMP)
Phone +49-30-94793-171
E-Mail: selenko@fmp-berlin.de
Öffentlichkeitsarbeit/Public Relations
Silke Oßwald
Phone +49-30-94793104
E-Mail: osswald@fmp-berlin.de
Das Leibniz-Institut für Molekulare Pharmakologie (FMP) gehört zum Forschungsverbund Berlin e.V. (FVB), einem Zusammenschluss von acht natur-, lebens- und umweltwissenschaftlichen Instituten in Berlin. In ihnen arbeiten mehr als 1.900 Mitarbeiter. Die vielfach ausgezeichneten Einrichtungen sind Mitglieder der Leibniz-Gemeinschaft. Entstanden ist der Forschungsverbund 1992 in einer einzigartigen historischen Situation aus der ehemaligen Akademie der Wissenschaften der DDR.
Media Contact
Weitere Informationen:
http://www.fmp-berlin.de/Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Diamantstaub leuchtet hell in Magnetresonanztomographie
Mögliche Alternative zum weit verbreiteten Kontrastmittel Gadolinium. Eine unerwartete Entdeckung machte eine Wissenschaftlerin des Max-Planck-Instituts für Intelligente Systeme in Stuttgart: Nanometerkleine Diamantpartikel, die eigentlich für einen ganz anderen Zweck bestimmt…

Neue Spule für 7-Tesla MRT | Kopf und Hals gleichzeitig darstellen
Die Magnetresonanztomographie (MRT) ermöglicht detaillierte Einblicke in den Körper. Vor allem die Ultrahochfeld-Bildgebung mit Magnetfeldstärken von 7 Tesla und höher macht feinste anatomische Strukturen und funktionelle Prozesse sichtbar. Doch alleine…

Hybrid-Energiespeichersystem für moderne Energienetze
Projekt HyFlow: Leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem für moderne Energienetze. In drei Jahren Forschungsarbeit hat das Konsortium des EU-Projekts HyFlow ein extrem leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem entwickelt, das einen…





















