Ein negatives Enzym liefert positive Resultate
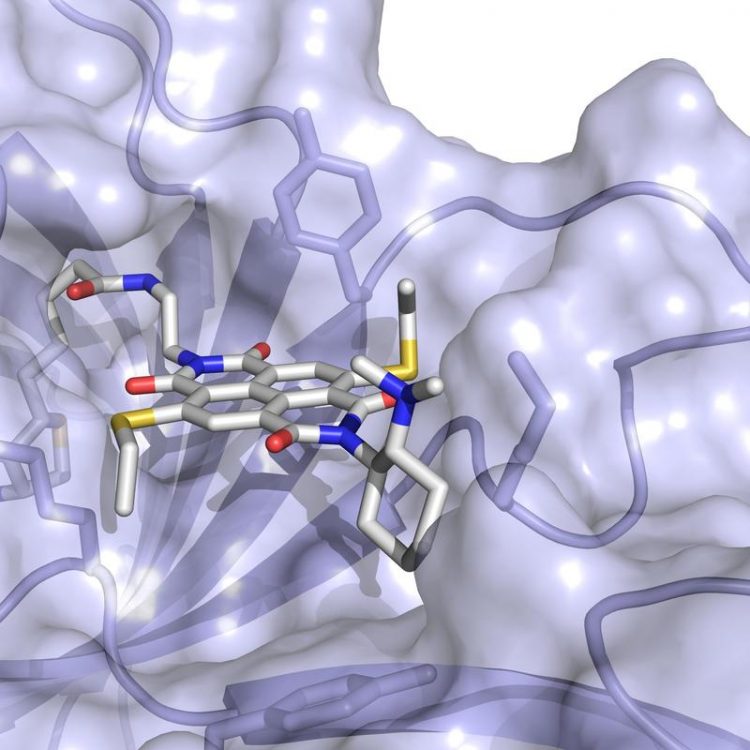
Das Anion-π-Enzym besteht aus einem elektronenarmen Aren-Kofaktor (graue Stäbchenrepresentation), eingebettet in ein Protein (als Oberfläche dargestellt). Universität Basel, Departement Chemie
Proteine sind die Arbeitspferde jeder Zelle. Sie bestehen aus Aminosäurebausteinen, die als Kette verbunden sind, welche sich zu funktionalen Maschinen zusammenfalten, um anschliessend alle wesentlichen zellulären Prozesse anzutreiben.
Für diese Aufgaben benötigt die Natur zwanzig solcher Aminosäurebausteine zusammen mit ein paar spezialisierten Kofaktoren, die häufig zu der Gruppe der Vitamine zählen. Chemiker haben intelligente Wege gefunden, wie man das natürliche Proteinrepertoire beispielsweise durch das Hinzufügen zusätzlicher nicht-natürlicher Aminosäuren oder Kofaktoren erweitern kann.
Die Forscher um Stefan Matile und Thomas Ward haben jetzt einen neuartigen Kofaktor geschaffen, welcher eine der klassischen Wechselwirkungen in Proteinen umkehrt: die Kationen-π-Bindung, also die Stabilisierung einer positiven Ladung durch Anlagerung an eine elektronenreiche Molekülebene. Die Natur verwendet diese Kationen-π-Bindungen bei der Herstellung von so wichtigen Molekülen wie Steroiden, Hormonen, Vitaminen, Sehpigmenten oder Duftstoffen, um Signale in das Gehirn zu vermitteln, Antigene zu erkennen und Ähnlichem.
Nun haben die Forschungsgruppen von Matile und Ward ihren neuen Kofaktor und das daraus resultierende künstlichen Protein verwendet, um zusammen das erste «Anionen-π-Enzym» der Natur zu bauen.
Darin ist die elektronenreiche durch eine elektronenarme Moleküleben ersetzt, wodurch eine negative Ladung während der Reaktion stabilisiert wird. Die Forscher konnten zeigen, dass Proteine mit dieser in der Natur nicht vorkommenden Funktionalität traditionelle organisch-chemische Katalysatoren in einer wichtigen, aber energetisch ungünstigen Reaktion bezüglich ihrer hohen Spezifität und Selektivität übertreffen.
Die Forscher sind optimistisch, dass dieser Ansatz in Zukunft in Zellen verwendet werden kann, um bisher unmögliche chemische Transformationen zu ermöglichen.
Die Autoren bedanken sich für die finanzielle Unterstützung durch den Nationalen Forschungsschwerpunkt (NFS) Molecular Systems Engineering und Chemische Biologie, bei der Universität Genf und der Universität Basel sowie dem Europäischen Forschungsrat.
https://www.unibas.ch/de/Aktuell/News/Uni-Research/Ein-negatives-Enzym-liefert-p…
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Neue universelle lichtbasierte Technik zur Kontrolle der Talpolarisation
Ein internationales Forscherteam berichtet in Nature über eine neue Methode, mit der zum ersten Mal die Talpolarisation in zentrosymmetrischen Bulk-Materialien auf eine nicht materialspezifische Weise erreicht wird. Diese „universelle Technik“…

Tumorzellen hebeln das Immunsystem früh aus
Neu entdeckter Mechanismus könnte Krebs-Immuntherapien deutlich verbessern. Tumore verhindern aktiv, dass sich Immunantworten durch sogenannte zytotoxische T-Zellen bilden, die den Krebs bekämpfen könnten. Wie das genau geschieht, beschreiben jetzt erstmals…

Immunzellen in den Startlöchern: „Allzeit bereit“ ist harte Arbeit
Wenn Krankheitserreger in den Körper eindringen, muss das Immunsystem sofort reagieren und eine Infektion verhindern oder eindämmen. Doch wie halten sich unsere Abwehrzellen bereit, wenn kein Angreifer in Sicht ist?…





















