Auch Krankenhauskeime haben Schwachstellen
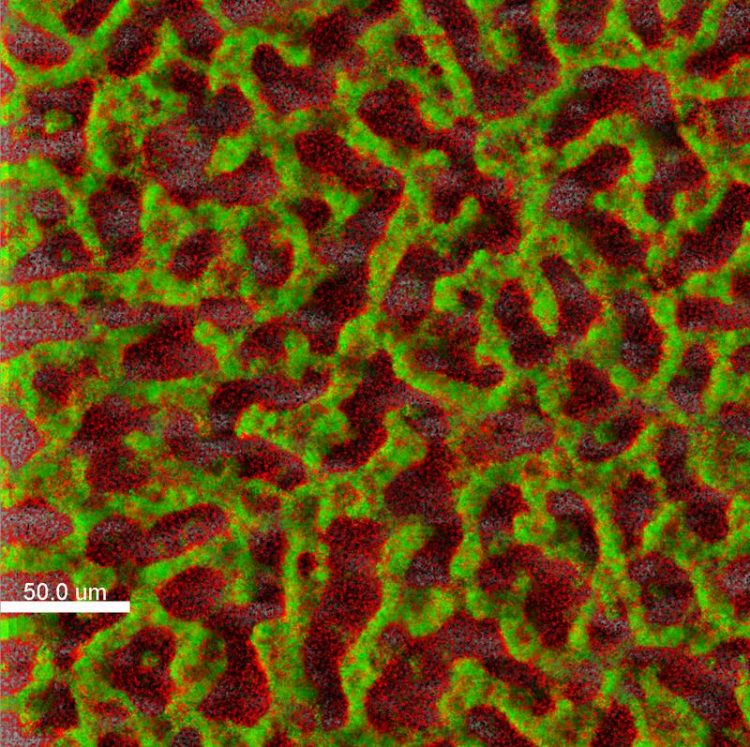
Der Krankenhauskeim Pseudomonas aeruginosa schützt sich in dichten Biofilmen vor Antibiotika und Angriffen des Immunsystems (grün = lebende Pseudomonas-Zellen; rot = tote Zellen). TWINCORE/Janne Thöming
Der Krankenhauskeim Pseudomonas aeruginosa kann gerade bei geschwächten Menschen unter anderem schwere Wundinfektionen sowie Infektionen der Lunge und der Harnwege auslösen. Pseudomonas schafft es dabei immer wieder, Angriffe des Immunsystems und Antibiotika-Therapien zu überdauern.
Ein Schlüssel zum Erfolg dieses hartnäckigen Erregers ist sein komplexes Kommunikationssystem: Über verschiedenste Signalstoffe stimmen sich die Bakterien untereinander ab und steuern so auch Infektionsprozesse. Wissenschaftler des Helmholtz-Zentrums für Infektionsforschung (HZI) in Braunschweig und des Helmholtz-Instituts für Pharmazeutische Forschung Saarland (HIPS) in Saarbrücken haben nun herausgefunden, wie die Bakterien die große Vielfalt an Signalmolekülen herstellen:
Indem ein einziger Proteinkomplex seine Form verändert, kann er Moleküle unterschiedlicher Größe zu Signalstoffen verarbeiten. Wenn es gelingt, einen Hemmstoff für diesen Komplex zu entwickeln, könnte dessen Bewegung eingefroren und die Kommunikation der Bakterien unterbrochen werden. Ihre Ergebnisse veröffentlichten die Wissenschaftler im Fachjournal ChemBioChem.
Mithilfe verschiedener Tricks passt sich der Krankheitserreger Pseudomonas aeruginosa (P. aeruginosa) seiner Umgebung perfekt an. Ob Lunge, Auge, Harntrakt, eine offene Wunde oder ein Implantat – Pseudomonaden können sich überall ansiedeln und vermehren. Sie schaffen es sogar, sich gegen die meisten Antibiotika zu behaupten, indem sie sich entweder in einem dichten Biofilm abschirmen oder die Giftstoffe einfach mit kleinen Pumpen aus ihrem Innern befördern.
Zu welchen effektiven Überlebensstrategien die Bakterien greifen, stimmen sie untereinander ab. Dazu setzen sie verschiedenste Signalmoleküle frei, die beim Überschreiten eines bestimmten Grenzwertes („Quorum“) die entsprechende Reaktion der Bakterien auslösen. Diese Art der Kommunikation wird „Quorum Sensing“ genannt – und zu allem Überfluss besitzt P. aeruginosa dafür gleich drei verschiedene Systeme, die miteinander in Verbindung stehen.
Ihre Anpassungsfähigkeit macht P. aeruginosa besonders schwer zu behandeln. Daher suchen Forscher weltweit nach Eigenschaften, die für diese Bakterien spezifisch sind und sich als Angriffspunkte für neuartige Medikamente eignen. Ein vielversprechendes Ziel ist eines der Kommunikationssysteme – das sogenannte pqs-System (für Pseudomonas Quinolone Signal), das in dieser Form nur in P. aeruginosa vorkommt. Schon lange ist bekannt, dass dieses System mit einem breiten Spektrum von Signalmolekülen arbeitet –nicht aber, wie die Vielfalt dieser Moleküle im Detail entsteht.
„Seit einigen Jahren wissen wir, dass ein Komplex aus den Proteinen PqsB und PqsC für die Signalvielfalt bei Pseudomonas aeruginosa verantwortlich ist“, sagt Prof. Wulf Blankenfeldt, der am HZI die Abteilung „Struktur und Funktion der Proteine“ leitet. „Dabei dient PqsB als Stabilisator, während PqsC die chemische Reaktion durchführt: Es bildet Moleküle ähnlicher Struktur mit unterschiedlich langen Fettsäureanhängen, wobei die genauen molekularen Grundlagen dafür bislang unbekannt waren.“
Um dem vielseitigen Proteinkomplex in die Trickkiste zu schauen, hat Florian Witzgall, Doktorand in Blankenfeldts Abteilung, den Proteinkomplex aufwendig gereinigt, kristallisiert und die dreidimensionale Struktur von PqsBC mithilfe der Röntgenstrukturanalyse entschlüsselt.
Das Ergebnis: „Der Komplex PqsBC formt eine Art Tunnel, der mal geöffnet und mal geschlossen ist“, sagt Witzgall. In der Strukturanalyse konnte er auch verschiedene Zwischenzustände identifizieren und davon ableiten, dass genau die Bereiche des Proteinkomplexes beweglich sind, die die Bindestelle für die Fettsäureketten umgeben.
„Wir vermuten, dass PqsBC seinen Tunnel aufklappt, eine Fettsäurekette darin aufnimmt, den Tunnel verschließt und die Fettsäure dann auf das zweite Substrat von PqsBC überträgt. Danach klappt der Tunnel wieder auf und entlässt das fertige Signalmolekül“, sagt Witzgall.
Die dreidimensionale Struktur des Proteinkomplexes zeigt auch, dass der Tunnel genau so lang ist, dass ihn eine Fettsäurekette aus acht Kohlenstoffatomen ausfüllt. „Demnach sollte dies die bevorzugte Länge sein, die der Komplex verarbeitet“, sagt Witzgall.
Weiterführende Experimente in Zusammenarbeit mit der HZI-Abteilung „Chemische Biologie“ von Prof. Mark Brönstrup haben die Vermutung bestätigt: Eine quantitative Analyse der umgesetzten Fettsäuren hat gezeigt, dass die Ketten aus acht Kohlenstoffatomen am häufigsten verbaut werden. „Dieses Ergebnis zeigt, wie fein das pqs-System abgestimmt ist, denn das Signalmolekül mit der entsprechenden Kohlenstoffkette wird am besten vom Rezeptor des pqs-Systems der Bakterien erkannt“, sagt Florian Witzgall.
Auch Dr. Martin Empting aus der Abteilung „Wirkstoff-Design und Optimierung“ sowie die Abteilung „Mikrobielle Naturstoffe“ von Prof. Rolf Müller am Helmholtz-Institut für Pharmazeutische Forschung Saarland (HIPS), einem Standort des HZI in Kooperation mit der Universität des Saarlandes, konnten bestätigen, dass Fettsäuren aus acht Kohlenstoffatomen von PqsBC bevorzugt werden. Die große Vielfalt der Signalstoffe komme dadurch zustande, dass sowohl kürzere als auch längere Fettsäuren in den Tunnel passen und verarbeitet werden können, allerdings weniger effizient.
„Es gibt schon seit längerer Zeit Hinweise auf eine erhöhte Flexibilität bei verwandten Proteinen. PqsBC ist nun aber das erste Beispiel für diese Proteinfamilie, bei dem die Beweglichkeit durch verschiedene Kristallstrukturen auch tatsächlich nachgewiesen wurde“, sagt Florian Witzgall. Die neuen Erkenntnisse zur Beweglichkeit von PqsBC eröffnen nun einen Ansatzpunkt für neuartige Medikamente. „Würden wir mit einem Wirkstoff die Bewegung von PqsBC einfrieren, könnten wir PqsBC gezielt hemmen und die Kommunikation von P. aeruginosa unterbrechen“, sagt Wulf Blankenfeldt.
Originalpublikation:
Florian Witzgall, Tobias Depke, Michael Hoffmann, Martin Empting, Mark Brönstrup, Rolf Müller and Wulf Blankenfeldt: The Alkylquinolone Repertoire of Pseudomonas aeruginosa is Linked to Structural Flexibility of the FabH‐like 2‐Heptyl‐3‐hydroxy‐4(1H)‐quinolone (PQS) Biosynthesis Enzyme PqsBC. ChemBioChem 2018, DOI: 10.1002/cbic.201800153
Ein Video zur Beweglichkeit von PqsBC und Bildmaterial zu dieser Pressemitteilung finden Sie auf unserer Webseite unter dem Link https://www.helmholtz-hzi.de/de/aktuelles/news/ansicht/article/complete/auch_kra…
Das Helmholtz-Zentrum für Infektionsforschung:
Am Helmholtz-Zentrum für Infektionsforschung (HZI) untersuchen Wissenschaftler die Mechanismen von Infektionen und ihrer Abwehr. Was Bakterien oder Viren zu Krankheitserregern macht: Das zu verstehen soll den Schlüssel zur Entwicklung neuer Medikamente und Impfstoffe liefern. Das HZI ist Mitglied im Deutschen Zentrum für Infektionsforschung (DZIF). http://www.helmholtz-hzi.de
Ihre Ansprechpartner:
Susanne Thiele, Pressesprecherin
susanne.thiele@helmholtz-hzi.de
Dr. Andreas Fischer, Wissenschaftsredakteur
andreas.fischer@helmholtz-hzi.de
Helmholtz-Zentrum für Infektionsforschung GmbH
Presse und Kommunikation
Inhoffenstraße 7
D-38124 Braunschweig
Tel.: 0531 6181-1400; -1405
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Neue universelle lichtbasierte Technik zur Kontrolle der Talpolarisation
Ein internationales Forscherteam berichtet in Nature über eine neue Methode, mit der zum ersten Mal die Talpolarisation in zentrosymmetrischen Bulk-Materialien auf eine nicht materialspezifische Weise erreicht wird. Diese „universelle Technik“…

Tumorzellen hebeln das Immunsystem früh aus
Neu entdeckter Mechanismus könnte Krebs-Immuntherapien deutlich verbessern. Tumore verhindern aktiv, dass sich Immunantworten durch sogenannte zytotoxische T-Zellen bilden, die den Krebs bekämpfen könnten. Wie das genau geschieht, beschreiben jetzt erstmals…

Immunzellen in den Startlöchern: „Allzeit bereit“ ist harte Arbeit
Wenn Krankheitserreger in den Körper eindringen, muss das Immunsystem sofort reagieren und eine Infektion verhindern oder eindämmen. Doch wie halten sich unsere Abwehrzellen bereit, wenn kein Angreifer in Sicht ist?…





















